
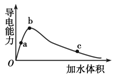
 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.| A. | 醋酸的电离程度:a<b<c | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
分析 醋酸为弱电解,浓度越小,电离程度越大,对于该溶液,电离程度反应了氢离子的浓度,溶液导电能力越大,离子浓度越大,结合溶液的电荷守恒分析.
解答 解:A.醋酸为弱电解质,加水促进电离,浓度越小,电离程度越大,则乙酸的电离程度:a<b<c,故A正确;
B.电离程度反应了氢离子的浓度,溶液导电能力越大,离子浓度越大,氢离子浓度越大,pH越小,故B正确;
C、由图象可看出,a点稀释导电能力增强,所以开始阶段以溶质的电离为主,则蘸取a点溶液滴在湿润的pH试纸上,测得pH值变小,而不是变大,故C错误;
D、随水的量增加,等体积混合溶液中和碱的能力逐渐降低,所以分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c,故D正确;
故选:C.
点评 本题考查弱电解质的电离,题目难度不大,注意把握弱电解质的电离特点,注意导电能力与离子浓度大小有关.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.
工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
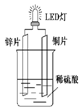 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  | 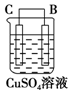 | 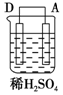 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅在高温下 | B. | 在任何温度下都不能自发进行 | ||
| C. | 在任何温度下 | D. | 仅在低温下 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com