
 氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.
氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.分析 (1)20mL 0.50mol/L盐酸和20mL 0.55mol/L NaOH溶液中和反应,盐酸的物质的量为0.01mol,反应生成0.01mol水,其反应热△H=-a kJ/mol(a>0),则生成2mol水放出的热量为200akJ;
(2)酸性条件下,氯离子与次氯酸根离子反应生成氯气;
(3)氯水中存在Cl2+H2O?H++Cl-+HClO,加碳酸钙消耗氢离子,平衡正移;
(4)Fe与次氯酸根离子形成原电池时,次氯酸根离子在正极上得电子;
(5)①NaClO的质量分数越高,反应所用时间越短;
②设溶液的体积为1L,则在2d时次氯酸钠的质量为1000×6.500%=65.00g,4d时次氯酸钠的质量为1000×5.755%=57.55g,其质量变化为7.45g,再求出物质的量变化及反应速率;
③电解冷饱和食盐水,在阴极上氢离子得电子生成氢气,氯离子在阳极失电子生成次氯酸根离子.
解答 解:(1)20mL 0.50mol/L盐酸和20mL 0.55mol/L NaOH溶液中和反应,盐酸的物质的量为0.01mol,反应生成0.01mol水,其反应热△H=-a kJ/mol(a>0),则生成2mol水放出的热量为200akJ,则稀硫酸与氢氧化钠的热化学方程式为H2SO4(aq)+2NaOH(aq)=Na2SO4 (aq)+2H2O (l)△H=-200a kJ/mol;
故答案为:H2SO4(aq)+2NaOH(aq)=Na2SO4 (aq)+2H2O (l)△H=-200a kJ/mol;
(2)酸性条件下,氯离子与次氯酸根离子反应生成氯气,氯气属于有毒气体,其反应的离子方程为:Cl-+ClO-+2H+=Cl2↑+H2O;
故答案为:Cl-+ClO-+2H+=Cl2↑+H2O;
(3)氯水中存在Cl2+H2O?H++Cl-+HClO,加碳酸钙消耗氢离子,生成二氧化碳,平衡正移,则反应的现象为氯水浅黄绿色逐渐褪去,同时产生少量气体;由于Cl2+H2O?H++Cl-+HClO的平衡正向移动,使HClO浓度加大,故漂白速率增大,漂白效果增强,所以溶液中滴加几滴石蕊试剂,发现试剂紫色迅速褪去;
故答案为:氯水浅黄绿色逐渐褪去,同时产生少量气体;大理石消耗了氯水中的H+,而使Cl2+H2O?H++Cl-+HClO的平衡向正向移动,使HClO浓度加大,故漂白速率增大,漂白效果增强;
(4)Fe与次氯酸根离子形成原电池时,次氯酸根离子在正极上得电子,则正极的电极反应式为:ClO-+2e-+H2O=Cl-+2OH-;
故答案为:ClO-+2e-+H2O=Cl-+2OH-;
(5)①由图可知,NaClO的质量分数越高,反应所用时间越短,反应速率越快;
故答案为:相同条件下,NaClO的质量分数越高,分解速率越快;
②设溶液的体积为1L,溶液的密度为1g/cm3,则在2d时次氯酸钠的质量为1000×6.500%=65.00g,4d时次氯酸钠的质量为1000×5.755%=57.55g,
其质量变化为7.45g,
则△n=$\frac{m}{M}$=$\frac{7.45g}{74.5g/mol}$=0.1mol,v=$\frac{\frac{0.1mol}{1L}}{2d}$=0.05mol/(L•d);
故答案为:0.05;
③电解冷饱和食盐水,在阴极上氢离子得电子生成氢气,氯离子在阳极失电子生成次氯酸根离子,则电解反应的离子方程式:Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑;
故答案为:Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑.
点评 本题考查了热化学方程式、有关方程式的计算、原电池原理和电解池原理的应用、反应速率的计算等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:解答题
 ,Cl的基态原子外围电子层排布式为3s23p5;
,Cl的基态原子外围电子层排布式为3s23p5;| 第一电离能 | 键能 | 沸点 |
| O>Na | H-Cl>H-Si | CO2<H2O |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物不同化学环境的氢原子有4种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能够发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:Y>Z>X | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SOCl2是氧化剂,Li是还原剂 | |
| B. | 2 mol SOCl2参加反应,共转移4 mol电子 | |
| C. | 若将该反应设计成原电池,SOCl2在正极发生反应 | |
| D. | 若将该反应设计成原电池,可用稀硫酸作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | Be | ② | ③ | Ne | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
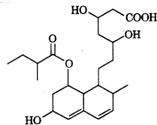 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )| A. | 分子中含有四种官能团 | |
| B. | 1 mol该物质最多可与3 mol NaOH反应 | |
| C. | 能发生加成反应、取代反应、水解反应 | |
| D. | 1 mol该物质最多可与2 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 550℃时,若充入惰性气体,v正,v退均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com