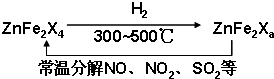解答:解:V、W、X、Y、Z是原子序数依次增大的五种短周期元素.V的原子序数与X的原子序数之和等于Y的原子序数,V和Y位于同一主族,且Y是一种非金属元素,则Y不可能为氢元素,所以V和Y的原子序数相差8,故X的原子序数为8,则X为氧元素;Y的最外层电子数≥4,即Y的原子序数≥14;W的原子序数与X的原子序数之和等于Z的原子序数,则W,Z的原子序数相差8,W、Z不可能处于同一周期,W的原子序数不可能为1,所以W、Z不可能是氢与氟组合,故W、Z也处于同一族,W的原子序数小于8,则Z的原子序数小于16,由于原子序数Z>Y,故Y为硅元素,Z为磷元素,则V为碳元素,W为氮元素.
(1)由上述分析可知,X为氧元素,Y为硅元素,Z为磷元素,同周期随原子序数增大,原子半径减小,所以原子半径Si>P,电子层越多,原子半径越大,所以原子半径P>O,故原子半径Si>P>O,故答案为:Si;P;O;
(2)W为氮元素,Z为磷元素;W与Z形成的单质分别为甲为氮气、乙为磷单质,最简单氢化物分别为丙为NH
3、丁为PH
3.
a.氮气比磷单质稳定,即稳定性甲>乙;氨气中存在氢键,沸点高,即丙>丁,故a正确;
b.氮气比磷单质稳定,即活泼性甲<乙;氨气中存在氢键,沸点高,即丙>丁,故b正确;
c.元素非金属性N>P,氢化物稳定性丙>丁;通常氮气为气体,磷单质为固体,沸点:甲<乙,故c错误;
d.元素非金属性N>P,氢化物稳定性丙>丁;通常氮气为气体,磷单质为固体,沸点:甲<乙,故d错误;
故选:a;
(3)VX
2为CO
2一定条件下可被还原为晶莹透明的晶体M,其结构中原子的排列为正四面体,出M及其同素异形体有:金刚石、足球烯、石墨等,
故答案为:金刚石、足球烯、石墨;
(4)工业上,将Al
2O
3、C单质、N
2单质按物质的量之比1:3:1在高温下反应可制得一种无机非金属材料AlN,该反应的化学方程式为 Al
2O
3+3C+N
2=2AlN+3CO;反应中C为还原剂,氮气为氧化剂,碳元素化合价由0价升高为+2价,当0.2molN
2参加反应,转移电子数目为0.2mol×3×2×N
Amol
-1=1.2N
A,
故答案为:Al
2O
3+3C+N
2=2AlN+3CO;1.2N
A;
(5)X为氧元素,新型纳米材料ZnFe
2O
a可由化合物ZnFe
2O
4经高温还原制得,若2mol ZnFe
2O
a与SO
2反应可生成0.75molS,则ZnFe
2O
a被还原为ZnFe
2O
4,令中铁元素的化合价为x,根据电子转移守恒,可知2mol×2×(3-x)=0.75mol×4,解得,x=2.25,利用化合价代数和为,2+2.25×2=2a,解得a=3.25;2molZnFe
2X
a可分解物质的量之比为3:2的NO
2、NO混合气体(均分解为N
2),反应中NO
2、NO被还原,ZnFe
2X
a被氧化为ZnFe
2O
4,令NO
2、NO的物质的量分别为3ymol、2ymol,根据电子转移守恒有3ymol×4+2ymol×2=2mol×2×(3-2.25),解得y=
,所以NO
2、NO混合气体的体积V=
×5mol×22.4L/mol=21L.
故答案为:3.25;21;
(6)X的常见氢化物为H
2O,在t℃时,将a g NH
3完全溶于水,得到VmL溶液,假如该溶液的密度为d g/cm
3,质量分数为w,其中含NH
4+的物质的量为b mol.
A.溶质的质量分数为w=
,故A错误;
B.溶质为NH
3,氨水的物质的量浓度为c=
mol/L=
mol/L,故B错误;
C.根据电荷守恒可知,溶液中c(OH
-)=
mol?L
-+c(H
+),故C正确;
D.上述溶液中再加入VmL水后,水的密度比氨水大,混合后质量大于原溶液的2倍,氨气质量不变,所得溶液的质量分数小于0.5w,故D错误.
故答案为:C.