
| A. | KMnO4 | B. | Na2O2 | C. | NH3•H2O | D. | NaClO |
科目:高中化学 来源: 题型:填空题
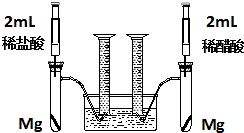 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②④⑥ | C. | ①③⑥ | D. | ③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该电池的正极为锌 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当0.1molZn完全溶解时,流经电解质溶液的电子个数为1.204×1023 | |
| D. | 电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
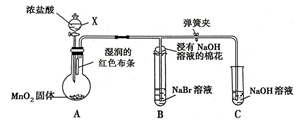 如图是一个制取氯气并验证氯气某些性质的装置.(夹持和加热装置省略)
如图是一个制取氯气并验证氯气某些性质的装置.(夹持和加热装置省略)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签信息,回答下列问题(葡萄糖稀溶液的密度约为1g/cm3):
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签信息,回答下列问题(葡萄糖稀溶液的密度约为1g/cm3):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③⑤ | C. | ②③④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH-$\stackrel{△}{→}$CH3COO-+CH3CH2O-+H2O | |
| B. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 乙醛溶液与新制氢氧化铜碱性悬浊液共热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$ CH3COO-+Cu2O↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
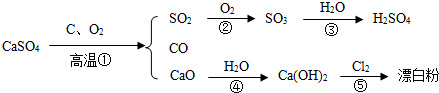
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com