
A.原子核外最外层电子数:A>C>B
B.离子半径:A2->C->B2+
C.B和C形成化合物的电子式为![]()
D.沸点:HC>H2A
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
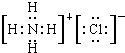
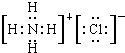
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期期中考试化学试卷(解析版) 题型:填空题
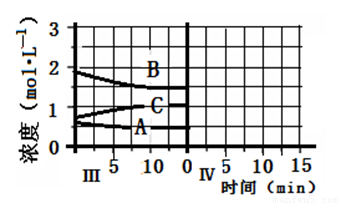
反应aA(g)+bB(g) cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
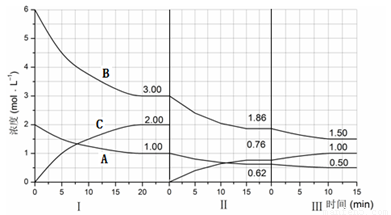
回答问题:
(1)反应的化学方程式中,a:b:c为 ;
(2)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最大的是 ,其值是 ;
(3)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(4)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3 (填“<”、“>或“=”),判断的理由是 ;
(5)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中B物质的浓度随时间变化的趋势(注:只须画出B的浓度随时间变化曲线)。
查看答案和解析>>
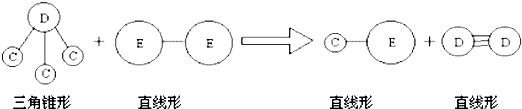
科目:高中化学 来源:四川省模拟题 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com