
| A、0.1mol?L-1的NH4Cl溶液C(Cl-)>C(NH4+)>C(OH-)>C(H+) |
| B、0.1mol?L-1的(NH4)2SO4溶液中:C(NH4+)=2 C(SO42-) |
| C、0.2mol?L-1的Na2CO3溶液中:C(OH-)=C(HCO3-)+C(H+)+C(H2CO3) |
| D、C(NH4+)相等的NH4HSO4溶液,NH4HCO3溶液和NH4Cl溶液中,C(NH4H SO4)<C( NH4Cl)<C(NH4HCO3) |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
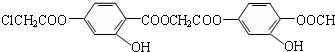 的说法,正确的是( )
的说法,正确的是( )| A、该有机物分子中含有氯原子、羟基、羧基等官能团 |
| B、该有机物可与浓溴水发生加成反应,但不能发取代去反应 |
| C、该有机物在酸性条件下水解,生成的有机物只有两种 |
| D、1mol该化合物最多可与10molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
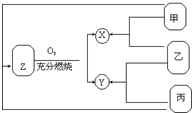 有甲、乙、丙三种常见单质,在一定条件下可按如图关系转化为X、Y、Z三种常见的化合物.问:
有甲、乙、丙三种常见单质,在一定条件下可按如图关系转化为X、Y、Z三种常见的化合物.问:查看答案和解析>>
科目:高中化学 来源: 题型:
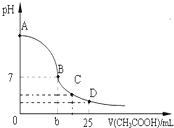 在25mL 0.1mol/L的NaOH溶液中逐滴加入0.2mol/L的CH3COOH溶液,溶液pH变化曲线如图所示.下列叙述中正确的是( )
在25mL 0.1mol/L的NaOH溶液中逐滴加入0.2mol/L的CH3COOH溶液,溶液pH变化曲线如图所示.下列叙述中正确的是( )| A、25℃时,A点溶液中水电离出的C(OH-)=0.1 mol/L |
| B、B点时NaOH溶液与CH3COOH溶液恰好完全反应 |
| C、C点时,溶液中离子浓度由大到小的顺序是:C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| D、在D点时,溶液中C(CH3COO-)+C(CH3COOH)═2C(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化氢通入浓H2SO4中 |
| B、稀H2SO4和乙酸乙酯共热 |
| C、浓H2SO4和C2H5OH共热到170℃ |
| D、潮湿的氯气通过盛有浓H2SO4的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
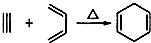 ,如果要合成
,如果要合成 所用的原始原料可以是
所用的原始原料可以是查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 向盐酸酸化的Ba(NO3)2溶液中通入SO2 | 有白色沉淀生成 | BaSO3难溶于酸 |
| B | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 溴乙烷与NaOH水溶液共热后,加HNO3酸化,滴加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷含溴元素 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
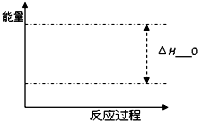 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.| 时间 物质 | 0min | 10min | 30min | 60min | 70min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com