
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):
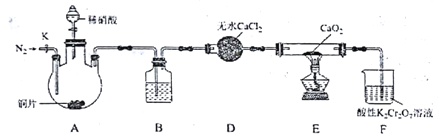
已知: 2NO+CaO2=Ca(NO2)2;2NO2+CaO2=Ca(NO3)2。
请回答下列问题:
(1)将分液漏斗中的稀硝酸滴入三颈烧瓶中的操作为① __________、② __________。
(2)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因为(用方程式表示)____。
(3)装置D的仪器名称是________;装置B所加试剂是_______。
(4)装置F中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3-,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式是__________________。
(5)己知:Ca(NO2)2溶液遇酸会产生NO气体。设计实验证明装置E中有亚硝酸钙生成:__________。
(6)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,反应原理为Ca(OH)2+NO +NO2=Ca(NO2)2+H2O。
①若n( NO):n(NO2)>l:l,则会导致____:
②若n( NO):n( NO2),则会导致____。
【答案】 凹槽与小孔对齐(将玻璃塞的凹槽与分液漏斗口的小孔对齐) 打开活塞,控制滴速(打开分液漏斗的活塞,控制稀硝酸以一定速度滴入三颈烧瓶) NO+O2=NO2(排出装置中的空气,防止空气中的氧气将NO氧化为NO2) (球形)干燥管 蒸馏水 Cr2O72-+2NO+6H+= 2Cr3++2NO3-+3H2O 取少量装置E中反应后的固体于洁净的试管中,滴加适量稀硫酸,试管口有红棕色气体产生,则装置E中有亚硝酸钙生成 排放NO气体,污染环境 产品中混有Ca(NO3)2杂质
【解析】试题分析:(1)根据压强原理,将分液漏斗中的稀硝酸滴入三颈烧瓶中,先将玻璃塞的凹槽与分液漏斗口的小孔对齐再打开活塞;(2)NO与O2反应生成NO2,NO2与CaO2反应生成Ca(NO3)2,制取的亚硝酸钙不纯;(3)根据图示回答D装置的名称;A中生成的NO中含有硝酸蒸汽,B装置除去NO中的硝酸蒸汽;(4)K2Cr2O7溶液可将剩余的NO氧化成NO3-,Cr2O72-被还原为Cr3+,根据电子守恒配平方程式;(5)Ca(NO2)2溶液遇酸会产生NO气体,NO遇空气生成红棕色的NO2;
(6)根据Ca(OH)2+NO +N02=Ca(N02)2+H2O,n( NO):n(NO2)>l:l,NO过量;n( NO):n( NO2)2过量,过量的NO2与Ca(OH)2反应生成Ca(NO3)2。
解析:(1)根据压强原理,将分液漏斗中的稀硝酸滴入三颈烧瓶中,操作为①将玻璃塞的凹槽与分液漏斗口的小孔、②打开活塞,控制硝酸滴速;(2)NO与O2反应生成NO2,NO+O2=NO2,通入一段时间的N2,可以排出装置中的空气,防止空气中的氧气将NO氧化为NO2;(3)根据图示,D装置的名称是球形干燥管;A中生成的NO中含有硝酸蒸汽,B装置的作用是除去NO中的硝酸蒸汽,所以B中的试剂可以是蒸馏水;(4)K2Cr2O7溶液可将剩余的NO氧化成NO3-,Cr2O72-被还原为Cr3+,根据电子守恒配平,离子方程式为Cr2O72-+2NO+6H+= 2Cr3++2NO3-+3H2O;(5)Ca(NO2)2溶液遇酸会产生NO气体,NO遇空气生成红棕色的NO2,证明装置E中有亚硝酸钙生成的方法是:取少量装置E中反应后的固体于洁净的试管中,滴加适量稀硫酸,试管口有红棕色气体产生,则装置E中有亚硝酸钙生成;
(6)根据Ca(OH)2+NO +NO2=Ca(NO2)2+H2O;①若n( NO):n(NO2)>l:l,NO过量,排放NO气体,污染环境;②若n( NO):n( NO2)2过量,过量的NO2与Ca(OH)2反应生成Ca(NO3)2,使产品中混有Ca(NO3)2杂质。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】[2015新课标Ⅰ]下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入1.0 mol·L1 Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
D | 将0.1 mol·L1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L1 CuSO4溶液 | 先有白色沉淀生成,后变为浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2 的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.苯的硝化反应和卤代反应都属于取代反应B.苯比甲苯难硝化
C.正丁烷和异丁烷性质上有差异D.硝基苯和三硝基甲苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,在三个干燥的烧瓶内分别装有纯净的NH3,含一半空气的HCl气体, NO2 和O2的混合气体[V(NO2)∶V(O2) = 4∶1 ],然后分别作喷泉实验,三个烧瓶内所得溶液的物质的量浓度之比为
A. 2∶1∶2 B. 5∶5∶4 C. 1∶1∶1 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理] 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
[实验内容及记录]
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=_____________________________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设。并继续进行实验探究。
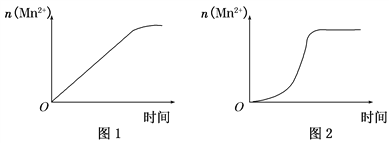
①该小组同学提出的假设是____________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | ________ | t |
③若该小组同学提出的假设成立,应观察到的现象是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应2A(g)+ B(g)![]() 2C(g)+D(s) △H<0,一段时间后反应达到平衡。此反应过程中测定的数据如下表所示,则下列说法正确的是
2C(g)+D(s) △H<0,一段时间后反应达到平衡。此反应过程中测定的数据如下表所示,则下列说法正确的是
t/min | 2 | 4 | 6 | 8 | 10 |
n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率ν(C)=0.02mol·L-1·min-1
B. 平衡后降低温度,反应达到新平衡前ν(逆)> ν(正)
C. 其他条件不变,10min后再充入一定量的A,平衡正向移动,A的转化率变小
D. 保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应: A(g)+xB(g)![]() 2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A. 平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B. x值等于3
C. A的转化率为20%
D. B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯的叙述中,下列正确的是( )
A. 氯气是一种黄绿色、有毒的气体
B. 氯元素在自然界中既可以以化合态存在,也可以以游离态存在
C. 氯气可用向下排空气法收集
D. 氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于一些金属的说法正确的是
A. 地壳中含量最多的金属是铁
B. Cu可以与浓硫酸反应生成氢气
C. Al可以与NH3 H2O反应生成白色沉淀
D. 钠露置与空气中,最终形成钠的稳定化合物是碳酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com