
| A. | x>y | B. | x<y | C. | x=y | D. | 不能确定 |
科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 所有金属与所有非金属原子之间都能形成离子键 | |
| C. | 配位键在形成时,由成键双方各提供一个电子形成共用电子对 | |
| D. | 金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液与CH3COOHNH4溶液均显中性,两溶液中水的电离程度相同 | |
| B. | CH3COONa溶液加水稀释:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 在NaHSO3溶液中,c(H+)+c(H2SO3)=c(OH-)+c(SO32-) | |
| D. | 含有AgCl和AgBr固体的悬浊液:c(Ag+)>c(Cl-)=c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L CCl4分子数目为0.1NA | |
| B. | 物质的量浓度为0.25mol/L的MgCl2溶液中,含有Cl-个数为0.5NA | |
| C. | 6.4g O2和O3的混合物中含有的氧原子数目为0.4NA | |
| D. | 用含3.01×1023个FeCl3的饱和溶液制备出的氢氧化铁胶体数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
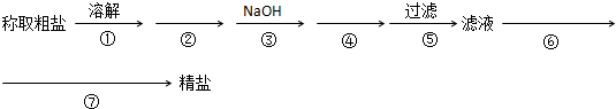
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
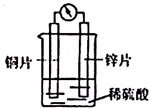
| A. | 溶液中H+向锌极移动 | |
| B. | 铜片是正极,发生氧化反应,有气泡产生 | |
| C. | 锌片上的电极反应式:Zn-2e-═Zn2+ | |
| D. | 电子由铜片经导线流向锌片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com