
| A. | 只有①⑤ | B. | 只有②④ | C. | 只有③⑥ | D. | 只有④⑥ |
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 0.30mol | C. | 0.35mol | D. | 0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
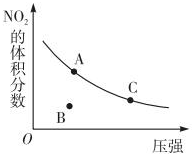
| A. | A、C两点的反应速率:v(A)>v(C) | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | B点正逆反应速率:v(正)>v(逆) | |
| D. | A、C两点气体的平均相对分子质量:A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{W}}{c{(H}^{+})}$=10-13 mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液:Na+、K+、SCN-、NO3- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:4 | C. | 1:2:3 | D. | 1:3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g) 在反应中被氧化为1mol SO3(g) 的△H=-99kJ/mol.回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g) 在反应中被氧化为1mol SO3(g) 的△H=-99kJ/mol.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| B. | CH≡CH和CH2=CHCH=CH2互为同系物 | |
| C. | 乙酸乙酯在碱性条件下的水解反应皂化反应 | |
| D. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com