
分析 (1)碳酸钙和盐酸反应生成氯化钙和二氧化碳;
(2)氢氧化钡溶液和稀硫酸反应生成硫酸钡和水;
(3)氧化铁与盐酸反应生成氯化铁和水;
(4)Fe2(SO4)3为强电解质完全电离;
(5)H++OH-=H2O可表示强酸与强碱反应生成可溶性盐和水;
(6)CO32-+2H+=CO2↑+H2O 表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应.
解答 解:(1)碳酸钙和盐酸反应生成氯化钙和二氧化碳,离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(2)氢氧化钡溶液和稀硫酸反应生成硫酸钡和水,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(3)氧化铁与盐酸反应生成氯化铁和水,其反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(4)硫酸铁是强电解质完全电离;电离方程式为:Fe2(SO4)3=2Fe3++3SO42-,
故答案为:Fe2(SO4)3=2Fe3++3SO42-;
(5)符合离子方程式H++OH-=H2O的反应是强碱强酸稀溶液发生的中和反应生成水和溶于水的盐;化学方程式为:NaOH+HCl=NaCl+H2O,
故答案为:NaOH+HCl=NaCl+H2O.
(6)CO32-+2H+=CO2↑+H2O 表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应,如Na2CO3+2HCl=CO2↑+H2O+2NaCl,
故答案为:Na2CO3+2HCl=CO2↑+H2O+2NaCl.
点评 本题考查了离子方程式书写、电离方程式,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分、注意反应必须遵循客观事实,题目难度不大.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 1g H2和8 gO2 | |
| B. | 0.1mol HCl 和2.24 L He | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
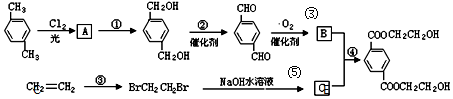
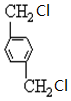 、B、
、B、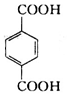 、C.HOCH2CH2OH、
、C.HOCH2CH2OH、 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$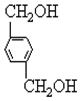 +2NaCl;
+2NaCl; ,反应的化学方程式是
,反应的化学方程式是 +4[Ag(NH3)2]OH$\stackrel{△}{→}$4Ag↓+6NH3↑+
+4[Ag(NH3)2]OH$\stackrel{△}{→}$4Ag↓+6NH3↑+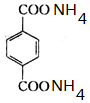 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | HClO?H++ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com