
【题目】二氧化硫在生产和生活中有着广泛的用途。
(1)SO2可用来制备定影剂Na2S2O3,,反应的化学方程式为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2↑。请用单线桥表示该反应中的电子转移情况______,还原剂与氧化剂的物质的量之比为____。
(2)用足量NaOH溶液吸收尾气中的SO2,反应的离子方程式为______;吸收后的浓溶液可用图1的装置再生循环脱硫,并制得硫酸,电极a的电极反应为_____,乙是____。
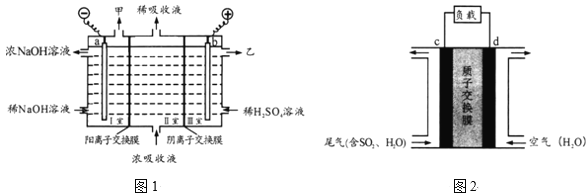
(3)可设计二氧化硫空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图2所示。其能量转化的主要形式是______,c电极是__极,移动的离子及方向是____。
【答案】![]() 1∶2 SO2+2OH-=SO42-+H2O 2H2O+2e-= H2↑+2OH-(或2H++2e-=H2↑) 浓度较大的H2SO4溶液 化学能转化成电能 负 H+由c电极通过质子交换膜向d电极移动
1∶2 SO2+2OH-=SO42-+H2O 2H2O+2e-= H2↑+2OH-(或2H++2e-=H2↑) 浓度较大的H2SO4溶液 化学能转化成电能 负 H+由c电极通过质子交换膜向d电极移动
【解析】
(1) Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2↑,反应中Na2S中S的化合价由-2价升高到+2价,SO2中S的化合价由+4价降低到+2价,根据化合价的变化分析解答;
(2)用足量NaOH溶液吸收尾气中的SO2,反应生成亚硫酸钠;吸收后的浓溶液可再生循环脱硫,并制得硫酸,根据化合价的变化,结合电解池原理分析解答;
(3)二氧化硫空气质子交换膜燃料电池属于原电池,结合原电池原理分析解答。
(1) Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2↑,反应中Na2S中S的化合价由-2价升高到+2价,Na2S为还原剂,SO2中S的化合价由+4价降低到+2价,SO2为氧化剂,反应中的电子转移情况用单线桥表示为![]() ,还原剂与氧化剂的物质的量之比为1∶2,故答案为:
,还原剂与氧化剂的物质的量之比为1∶2,故答案为:![]() ;1∶2;
;1∶2;
(2)用足量NaOH溶液吸收尾气中的SO2,反应生成亚硫酸钠,反应的离子方程式为SO2+2OH-=SO32-+H2O;吸收后的浓溶液可再生循环脱硫,并制得硫酸,根据图示,电极a为阴极,溶液中的氢离子放电发生还原反应,电极反应为2H2O+2e-= H2↑+2OH-(或2H++2e-=H2↑),电极b为阳极,SO32-在阳极发生氧化反应生成硫酸,因此乙是浓度较大的H2SO4溶液,故答案为:SO2+2OH-=SO32-+H2O;2H2O+2e-= H2↑+2OH-(或2H++2e-=H2↑);浓度较大的H2SO4溶液;
(3)二氧化硫空气质子交换膜燃料电池属于原电池,原电池的能量转化是化学能转化成电能,二氧化硫为燃料,在负极上发生氧化反应,通入空气的电极为正极,因此c电极是负极,溶液中的氢离子由c电极通过质子交换膜向d电极移动,故答案为:化学能转化成电能;负;H+由c电极通过质子交换膜向d电极移动。


科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1) 化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(2)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。

①M点的v正_________Q点的v正(填“>”“<”或“=”)。
②T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数K=_____________ (用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示。写出总反应化学方程式:_____________。


②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如上图所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是__________。
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如题图所示。若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为_____mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N
2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N![]() N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
A.全部B.①③④⑤C.②③④⑤⑦D.①③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将充有a mL NO和b mL NO2气体的试管倒立于水槽中,然后通入a mL O2。气体体积均在同温同压下测定,且b>a,则充分反应后,试管中气体在同温同压下的体积为( )
A.![]() mLB.
mLB.![]() mL
mL
C.![]() mLD.
mLD.![]() mL
mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生成氮肥的原料。回答下列问题:
(1)氮气的电子式________________ ,氨的结构式__________________;
(2)氨水显碱性,写出氨水的电离方程式___________________________________________;
(3)氨催化氧化生成NO是工业制硝酸的反应之一,写出该反应的化学方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物数量众多,分布极广,与人类关系非常密切。
(1)石油裂解得到某烃A,其球棍模型为![]() ,它是重要的化工基本原料。
,它是重要的化工基本原料。
①A的结构简式为_________,A的名称是____________。
②A与溴的四氯化碳溶液反应的化学方程式为_______________。

③A→C的反应类型是____,C+D→E的化学方程式为_______,鉴别C和D的方法是_______。
④A的同系物B的相对分子质量比A大14,B的结构有____种。
(2)生苹果肉遇碘酒变蓝,熟苹果汁能与银氨溶液反应,苹果由生到成熟时发生的相关反应方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年1月南开大学周其林团队因《高效手性螺环催化剂的发现》获得国家自然科学一等奖。下面为两种简单碳螺环化合物,相关的说法正确的是

A.上述两种物质中所有碳原子处于同一平面
B.螺[3,3]庚烷的一氯代物有2种
C.螺[3,4]辛烷与3-甲基-1-庚烯互为同分异构体
D.![]() 的名称为螺[5,4]壬烷
的名称为螺[5,4]壬烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种利用锂电池“固定 CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将 CO2转化为 C 和 Li2CO3,充电时选用合适催化剂会释放出 CO2。下列说法正确的是
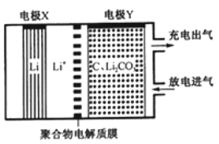
A.该电池放电时,Li+向电极 X 方向移动
B.该电池放电时,每转移 4 mol 电子,理论上生成 1mol C
C.该电池充电时,电极Y 与外接直流电源的负极相连
D.该电池充电时,阳极反应式为:C+2Li2CO3-4e- = 3CO2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.9molL-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A.0.03molL-1min-1B.1.8molL-1min-1
C.1.2molL-1min-1D.0.18molL-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com