
【题目】合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸): Cu(NH3)2Ac+CO+NH3==Cu(NH3)3 (CO) Ac。
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为________。
(2)配合物Cu(NH3)3 (CO) Ac中心原子的配位数为________,基态铜原子核外电子排布式为_________________。
(3)写出与CO互为等电子体的粒子________ (任写一个) 。
(4)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中,C原子轨道的杂化类型为________;1 mol尿素分子中,σ键的个数为____________。(设NA为阿伏加德罗常数的值)
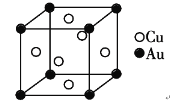
(5)铜金合金形成的晶胞如图所示,其中Cu、Au原子个数比为________。铜单质晶胞与铜金合金的晶胞相似,晶胞边长为3.61×10-8cm,则铜的密度为________g/cm-3(结果保留3位有效数字)。
【答案】N>O>C41s2 2s2 2p6 3s2 3p6 3d10 4s1CN-、N2等(其他合理答案)sp2杂化7NA3∶19.04
【解析】
(1)一般来说非金属性越强,第一电离能越大,但是因为p轨道半充满体系具有很强的稳定性,会有特例,如N的p轨道本来就是半充满的,O的p轨道失去一个电子才是半充满的,所以O比N容易失去电子;(2)根据化合物的化学式判断,一价铜离子有三个氨基配体和一个羰基配体,共4个配体;铜原子的核外电子排布为1s22s22p63s23p63d104s1,一价铜离子为失去一个电子,核外电子排布为1s22s22p63s23p63d10或[Ar]3d10;(4)计算杂化类型时根据电子对数来判断,中心原子的价电子数与配体电子数的和除以2就得到电子对数,根据电子对数,可以确定杂化类型;(5)计算晶胞中原子个数时,首先数一下原子个数,然后看其被几个晶胞共用,乘以相应的倒数即可;晶胞中微粒个数的计算用均摊法。
(1)一般来说非金属性越强,第一电离能大,所以O>N>C.但是因为p轨道半充满体系具有很强的稳定性.N的p轨道本来就是半充满的.O的p轨道失去一个电子才是半充满的.所以O比N容易失去电子,故答案为:N>C>O;(2)一价铜离子有三个氨基配体和一个羰基配体,共4个配体,故答案为:4;铜原子的核外电子排布为1s22s22p63s23p63d104s1;故一价铜离子的核外电子排布为1s22s22p63s23p63d10或[Ar]3d10;(3)价电子数与原子数都分别相等的粒子是等电子体,因此与CO互为等电子体的一种分子和一种离子的化学式分别是N2或CN-等;(4)中心原子为碳,价电子数为4,氧不为中心原子,不提供电子,每个亚氨基提供一个电子,电子对数为(4+1×2)÷2=3,故杂化轨道为sp2;σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA;(5)每个晶胞中铜位于面心,每个铜原子,被两个晶胞共用,每个晶胞中铜原子的个数为6×0.5=3,金原子位于角上,每个金原子被8个晶胞共用,故每个晶胞中金原子个数为8×0.125=1,故铜金原子个数比为3:1;铜单质晶胞与铜金合金的晶胞相似,晶胞边长为3.61×10-8cm,则铜的密度为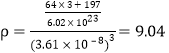 g/cm-3。
g/cm-3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A. 检验试液中的SO42-![]()
B. 检验试液中的Fe2+![]()
C. 检验试液中的I-![]()
D. 检验试液中的CO32-![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色。则正确的

A. 用激光笔照射,会出现丁达尔效应
B. 将液体静置片刻,会出现沉淀现象
C. 所得胶体中分散质的粒子直径大于100nm
D. 可用滤纸分离提纯得到氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
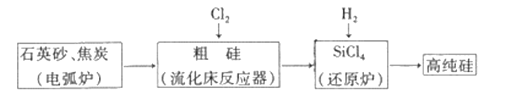
已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是

A. 外电路的电流方向为X![]() 外电路
外电路![]() Y
Y
B. 若两电极分别为Fe和碳棒,则X 为碳棒,Y 为Fe
C. X 极上发生的是还原反应,Y 极上发生的是氧化反应
D. 若两电极都是金属,则它们的活泼性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法,直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,下列能表示反应:X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1:2:2;②Y的消耗速率与Z的消耗速率相等;③容器中的压强不再发生变化;④单位时间内生成n mol Z的同时消耗nmol Y
A. ①② B. ①④ C. ③④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,B是地壳中含量最高的金属元素,C单质的晶体是良好的半导体材料,D的最外层电子数与内层电子数之比为3:5。
(1)C的原子结构示意图为______,D在元素周期表中的位置______。
(2)A单质在氧气中燃烧生成化合物甲,甲中所含化学键为________;A单质在E单质中燃烧生成化合物乙,用电子式表示乙的形成过程__________________。
(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应的化学方程式为________________。
(4)E元素的非金属性强于D元素,用原子结构解释原因:同周期元素随着原子序数的递增,______________________________,非金属性增强。
(5)工业上将干燥的E单质通入D熔融的单质中可制得化合物D2E2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com