
| A. | w=$\frac{36.5a}{(36.5a+22400)}$ | B. | w=$\frac{36.5c}{1000b}$ | ||
| C. | C=$\frac{1000ab}{(36.5a+22400)}$ | D. | b=$\frac{(36.5a+22400)}{(a+1)}$ |
分析 A.根据w=$\frac{溶质的质量}{溶液的质量}$×100%,计算判断;
B.根据w=$\frac{溶质的质量}{溶液的质量}$×100%计算;
C.根据n=$\frac{V}{{V}_{m}}$计算氯化氢的物质的量,再根据m=nM计算氯化氢质量,溶液的质量=1000g+m(HCl),结合密度求出溶液的体积,根据物质的量浓度公式c=$\frac{n}{V}$计算溶液的物质的量浓度;
D.密度=$\frac{质量}{体积}$.
解答 解:A.w=$\frac{溶质的质量}{溶液的质量}$×100%=$\frac{36.5a}{36.5a+1000}$,故A错误;
B.w=$\frac{溶质的质量}{溶液的质量}$×100%=$\frac{36.5a}{36.5a+1000}$,故B错误;
C.标准状况下的aL HCl(气)的物质的量为$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol.
氯化氢的质量为$\frac{a}{22.4}$mol×36.5g/mol=$\frac{36.5a}{22.4}$g.
所以溶液质量为1000g+$\frac{36.5a}{22.4}$g=(1000+$\frac{36.5a}{22.4}$)g.
所以溶液的体积为$\frac{1000+\frac{36.5a}{22.4}}{b}$=$\frac{22400+36.5a}{22.4b}$mL.
所以溶液浓度为$\frac{\frac{a}{22.4}}{\frac{22400+36.5a}{22.4b}×1{0}^{-3}}$=$\frac{1000ab}{22400+36.5a}$mol/L,故C正确;
D.气体溶于水后体积不是a+1L,故D错误.
故选C.
点评 本题考查了物质的量浓度的有关计算,有一定的难度,明确气体溶与水后体积不是二者的和是解题的关键.


科目:高中化学 来源: 题型:选择题
 ,则下列说法正确的是( )
,则下列说法正确的是( )| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和④ | |
| C. | 发生水解反应时,被破坏的键是① | |
| D. | 发生消去反应时,被破坏的键是②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、干冰、纯碱 | B. | 硝酸、二氧化硫、苛性钠 | ||
| C. | 盐酸、氧化铜、熟石灰 | D. | 醋酸、水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

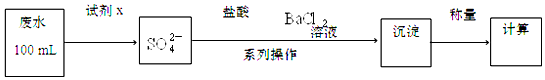
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与盐酸反应最剧烈,产生的氢气最多 | |
| B. | 铝与盐酸反应的速率仅次于钠,产生的气体也没有钠与盐酸反应产生气体多 | |
| C. | 铁与盐酸反应产生的气体比铝与盐酸反应产生的气体多 | |
| D. | 铝与盐酸反应和铁与盐酸反应产生的气体一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
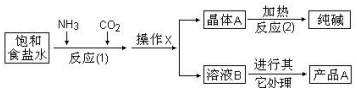
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com