
【题目】下列说法正确的是( )
A.根据类推思想,氯化铝溶液蒸干后灼烧,最后得到氧化铝,则硫酸铝也一样
B.高温高压下的超临界水,溶液中的氢离子和氢氧根离子浓度较大,有时显酸性,有时显碱性
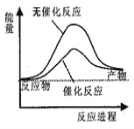
C.如图可表示水分解过程中的能量变化
D.等体积、等浓度的醋酸钠溶液和次氯酸钠溶液中,所含离子总数前者小于后者
【答案】C
【解析】
A项、硫酸铝在溶液中水解生成氢氧化铝和硫酸,因硫酸不挥发,加热蒸干得到硫酸铝,故A错误;
B项、高温高压下的超临界水,溶液中的氢离子和氢氧根离子浓度虽然较大,但氢离子浓度依然等于氢氧根浓度,溶液依然呈中性,故B错误;
C项、水的分解反应是吸热反应,反应物总能量小于生成物总能量,使用催化剂,能够降低反应的活化能,故C正确;
D项、醋酸钠溶液和次氯酸钠溶液中存在电荷守恒关系:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)、c(Na+)+c(H+)=c(ClO-)+c(OH-),由于酸性CH3COOH>HClO,则水解程度醋酸钠小于次氯酸钠,c(H+)前者大于后者,所以等浓度的醋酸钠溶液和次氯酸钠溶液中,离子总数前者大于后者,故D错误;
故选C。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 molBaCl2晶体中所含离子总数为0.1NA
B.25℃时,pH=1的HCl溶液中含有H+ 的数目为0.1NA
C.l7g H2O2中含有非极性键数目为0.5NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料。如图是某化工厂对海水资源综合利用的示意图:

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,过滤,最后向滤液中加入盐酸至滤液呈中性。请写出加入盐酸后发生反应的离子方程式:____________________________。
(2)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度思考,在母液里加入石灰乳起____________作用?
(3)海水里的镁元素处于游离态还是化合态_________?从海水中提取氯化镁的反应是不是氧化还原反应_________?为什么_________________?
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却?________。
A.H2
B.CO2
C.空气
D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的二氧化碳分别通入:①氯化钙溶液 ②硅酸钠溶液 ③氢氧化钙溶液 ④饱和碳酸钠溶液。最终溶液中有白色沉淀析出的是( )
A.①②③④
B.②④
C.①②③
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:HIn(红色)![]() H++In-(黄色)。浓度为0.02mol·L-1的下列各溶液:①盐酸 ②石灰水 ③食盐水 ④NaHSO4溶液 ⑤纯碱溶液 ⑥氨水。其中能使指示剂显红色的是( )
H++In-(黄色)。浓度为0.02mol·L-1的下列各溶液:①盐酸 ②石灰水 ③食盐水 ④NaHSO4溶液 ⑤纯碱溶液 ⑥氨水。其中能使指示剂显红色的是( )
A.①④⑤B.②⑤⑥C.①④D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中发生如下反应:N2O4(g)![]() 2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
A. 若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深
B. 若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变
C. 若体积不变,向容器中再加入一定量的N2O4,平衡向逆反应方向移动,再次平衡时N2O4的转化率将降低
D. 若体积不变,升高温度,再次平衡时体系颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
Fe2+ ![]() Fe3+
Fe3+ ![]() FeO42-(高铁酸根离子)
FeO42-(高铁酸根离子)
回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是______nm。
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:_____________。检验反应后溶液中还存在Fe3+的试剂是__________。
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是_______________,生成1molNa2FeO4转移电子数目为__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.硅酸钠溶液与盐酸反应![]() +2HCl=2Cl-+ H2O+SiO2↓
+2HCl=2Cl-+ H2O+SiO2↓
B.水玻璃中通入过量二氧化碳![]() +CO2+H2O=
+CO2+H2O=![]() +H2SiO3↓
+H2SiO3↓
C.硅酸与氢氧化钠溶液反应H2SiO3+ OH-=![]() + H2O
+ H2O
D.SiO2与氢氧化钠溶液反应SiO2+2OH-=![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能。
(1)氢气燃烧时耗氧量小,发热量大。已知,热化学方程式:
C(g)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是________。
(2)氢能源有可能实现能源贮存,也有可能实现经济、高效的输送。研究表明在过渡金属型氢化物(又称间充氢化物)中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64g·cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com