
| A、铁有剩余 |
| B、反应中氧化产物与还原产物的质量之比为2:5 |
| C、往溶液滴入KSCN溶液显红色 |
| D、溶液中的Fe2+和Fe3+的物质的量之比为1:6 |
| 1.12g |
| 56g/mol |
| 1.12g |
| 56g/mol |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
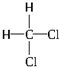 和
和
2 1 |
1 1 |
 和
和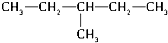
 CH2=CH-CH2CH3 和 CH3-CH=CH-CH3
CH2=CH-CH2CH3 和 CH3-CH=CH-CH3 纤维素与淀粉.
纤维素与淀粉.查看答案和解析>>
科目:高中化学 来源: 题型:
 向1L密闭容器中加入I2和
向1L密闭容器中加入I2和 各0.1mol,在一定条件下,发生反应:I2(g)+
各0.1mol,在一定条件下,发生反应:I2(g)+ (g)?
(g)? (g)+2HI(g)△H>0 测得体系中n(I2)随时间t变化如图所示,下列有关说法错误的是( )
(g)+2HI(g)△H>0 测得体系中n(I2)随时间t变化如图所示,下列有关说法错误的是( )A、单位时间内生成等物质的量的 和 和 时,反应达到平衡 时,反应达到平衡 |
| B、0-10min内生成HI的反应速率0.0088mol.L-1.min-1 |
C、10min时, 的转化率为44.0% 的转化率为44.0% |
| D、t1后图线变化可能是反应体系温度升高所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组通过查阅资料得到如下信息,乙醇在加热条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如表所示.
某研究性学习小组通过查阅资料得到如下信息,乙醇在加热条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如表所示.| 溶解性(本身均可做溶剂) | 沸点(℃) | 密度(g/mL) | |
| 乙醇 | 与水混溶,易溶于有机溶剂 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4 |
| B、C2H4 |
| C、C3H6 |
| D、C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌是阴极,Ag2O是阳极 |
| B、电解质溶液为碱溶液,不可能是强酸溶液 |
| C、锌电极的反应式为:Zn+2OH--2e-=Zn(OH)2 |
| D、若工作时转移电子0.2mol,则消耗Zn的质量为6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组为合成1丙醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1丙醇,查阅资料得知一条合成路线:| 一定条件 |
| H2 |
| Ni△ |
| 浓H2SO4 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com