
【题目】有A、B、C、D四种常见的金属单质,A元素在地壳中含量位列第6,A的密度为0.97 g/cm3;B为紫红色固体,锈蚀时变为绿色;C在空气中加热融化但不滴落;D在氧气燃烧,火星四射。根据以上信息回答下列问题:写出对应化学式:
(1)A在室温下与氧气反应生成______,D在空气中锈蚀生成的氧化物为_____。
(2)写出下列化学方程式:
①A在空气中燃烧_______________;
②B长期置于空气中变成绿色物质_________。
(3)将5 g钠铝合金投入200 mL的水中,固体完全溶解,产生4.48 L标准状态下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为______,所得溶液中溶质的物质的量浓度为_____(假设溶液体积变化忽略不计)。
【答案】Na2O Fe2O3 2Na+O2 ![]() Na2O2 2Cu+O2+CO2+H2O=Cu2(OH)2CO3 1:1 0.5 mol/L
Na2O2 2Cu+O2+CO2+H2O=Cu2(OH)2CO3 1:1 0.5 mol/L
【解析】
根据A元素在地壳中含量位列第6,密度为0.97 g/cm3,可推知A是Na;B为紫红色固体,锈蚀时变为绿色,故B是Cu;C在空气中加热熔化但不滴落,故C是Al;D在氧气中燃烧,火星四射,则D是Fe。
(1)A为Na,在室温下与氧气反应生成氧化钠,D为Fe,在空气中锈蚀生成的氧化物为Fe2O3;
(2)①Na在空气中燃烧的方程式为2Na+O2 ![]() Na2O2
Na2O2
②Cu长期置于空气中变成绿色物质的化学方程式为2Cu+O2+CO2+H2O=Cu2(OH)2CO3
(3)溶液中只有一种溶质,应该是NaAlO2,根据原子守恒可知钠铝合金中两种金属的物质的量之比为1:1,根据质量可得二者物质的量均是0.1mol,因此所得溶液中溶质的物质的量浓度为c(NaAlO2)=![]() 。
。


科目:高中化学 来源: 题型:
【题目】SO2通过下列工艺流程可制化工业原料H2SO4和清洁能源H2。
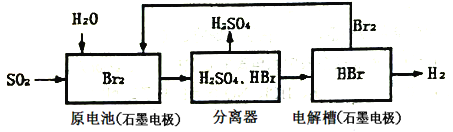
下列说法中错误的是
A. 电解槽中不能用铁电极代替石墨作为阳极
B. 原电池中负极的电极反应为:SO2+2H2O-2e-=SO42-+4H+
C. 该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4
D. 该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由合成气制备二甲醚,涉及如下反应:
(i)2CH3OH(g)![]() C2H4(g)+2H2O(g) ΔH1
C2H4(g)+2H2O(g) ΔH1
(ii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
能量变化如图所示:
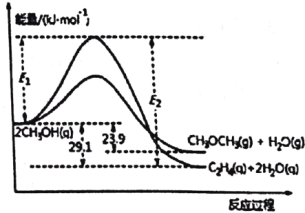
下列说法正确的是
A. ΔH1<ΔH2
B. 反应(ii)为吸热反应
C. C2H4(g)+H2O(g)![]() CH3OCH3(g) ΔH = -5.2 kJ·mol-1
CH3OCH3(g) ΔH = -5.2 kJ·mol-1
D. 若在容器中加入催化剂,则E2-E1将变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g)![]() pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了nmol/L,C的浓度增加了2n/3mol/L,又知,平均反应速率VC=2VB.达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,则该反应的化学方程式应为
pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了nmol/L,C的浓度增加了2n/3mol/L,又知,平均反应速率VC=2VB.达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,则该反应的化学方程式应为
A. 2A(g)+6B(g)![]() 3C(g)+5D(g)
3C(g)+5D(g)
B. 3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
C. 3A(g)+B(g)![]() 2C(g)+D(g)
2C(g)+D(g)
D. A(g)+3B(g)![]() 3C(g)+3D(g)
3C(g)+3D(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A可发生如图所表示的反应:
写出相应物质的化学式和类别(填在表格内),并依次写出各步反应的化学方程式。
A | B | C | D | E | |
化学式 | Cu | CuCl2 | ____ | ____ | ____ |
类 别 | _____ | _____ | 碱 | 氧化物 | 盐 |

(1)______________________________。
(2)______________________________。
(3)______________________________。
(4)______________________________。
(5)______________________________。
(6)______________________________ 。
(7)______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 容器内压强P:P甲=P丙>2P乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比 k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com