
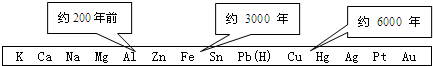
 .
.分析 (1)由图可以判断出金属活动性与开发利用的先后关系;
(2)钠的密度小于水,钠和水剧烈反应生成氢氧化钠和氢气且放出大量热,钠的熔点较低,氢氧化钠的电子式为: ;
;
(3)氢氧化钠溶液和铝反应生成偏铝酸钠和氢气,铝与氢氧化钠和盐酸反应的实质都是铝与氢离子之间的氧化还原反应,放出等量的气体,说明参加反应的铝相同,与氢氧化钠生成偏铝酸钠,与盐酸生成氯化铝,所以NaOH和HCl物质的量之比为1:3.
解答 解:(1)由图示可以看出金属的活动性大小与金属的开发利用的先后有关,故答案为:D;
(2)钠的密度小于水,所以会浮在水面上,熔点较低,钠和水放出大量的热,所以钠会熔成一个小球,和水反应生成氢气,生成的气体使钠受力不均,所以钠在水中到处游动,钠和水反应方程式为:2Na+2H2O=2NaOH+H2↑,氢氧化钠的电子式为: ,
,
故答案为:2Na+2H2O=2NaOH+H2↑;bc; ;
;
(3)氢氧化钠溶液和铝反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝与氢氧化钠和盐酸反应的实质都是铝与氢离子之间的氧化还原反应,放出等量的气体,说明参加反应的铝相同,与氢氧化钠生成偏铝酸钠,与盐酸生成氯化铝,所以NaOH和HCl物质的量之比为1:3,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;1:3.
点评 本题考查了钠、铝的性质,根据钠和水的反应现象探究钠的性质,结构决定性质,性质体现结构,根据钠原子和铝原子结构的不同分析其性质不同,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 2.0 | 1.0 | 0.8 | 0.7 | 0.7 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气含有的分子数目为nA | |
| B. | 1 mol H2所含有的电子数目为nA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 nA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和CH3OH | B. | CO2和H20 | C. | H2和CO2 | D. | CH3OH和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 将X与Y用导线连接,浸入电解质溶液中,Y极上有气泡产生 |
| 2 | 将片状X、W分别投入等浓度的稀盐酸中都有气体产生,W比X反应剧烈 |
| 3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出Z |
| A. | 上述四种金属中,Z的单质还原性最弱 | |
| B. | w的还原性强于Y的还原性 | |
| C. | Z放人CuSO4溶液中一定有Cu析出 | |
| D. | 用X、Z和稀硫酸可构成原电池,X作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去镁粉中少量的铝粉,加足量氢氧化钠溶液反应后,过滤 | |
| B. | 做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸 | |
| C. | 金属钠可以保存在煤油里 | |
| D. | 可用过滤的方法除去氢氧化铁胶体中的氯化铁溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com