
分析 (1)25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010、c(OH-).c(H+)=10-14,则该溶液中c(H+)=0.01mol,根据c(HA)与c(H+)相对大小确定酸强弱;
0.01mol/L的BOH溶液pH=12,该溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L,根据c(OH-)与c(BOH)相对大小确定电解质强弱;
(2)HA是弱酸,在水溶液中存在电离平衡;该溶液中水电离出的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{0.01}$mol/L;
(3)加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液中c(HA)、c(A-)减小,溶液温度不变,离子积常数不变,则溶液中c(OH-)增大;
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合,二者恰好反应生成BA,BA为强碱弱酸盐,酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),但其水解程度较小,结合电荷守恒判断离子浓度大小;
(5)常温下pH=12的BOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L,硫酸氢钠是强酸酸式盐,其完全电离生成钠离子、氢离子和硫酸根离子,相当于强酸性溶液,硫酸氢钠溶液中c(H+)=0.01mol/L,混合溶液pH=11>7,混合溶液中$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,则混合溶液呈碱性,混合溶液中c(OH-)=$\frac{0.01mol/L×0.1L-0.01mol/L×xL}{(0.1+x)L}$=0.001mol/L,据此计算x值.
解答 解:(1)25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010、c(OH-).c(H+)=10-14,则该溶液中c(H+)=0.01mol/<0.1mol/L,所以HA是弱酸,则HA是弱电解质;
0.01mol/L的BOH溶液pH=12,该溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L=c(BOH),所以BOH是强碱,则BH是强电解质;
故答案为:弱电解质;强电解质;
(2)HA是弱酸,在水溶液中存在电离平衡,电离方程式为HA?H++A-;该溶液中水电离出的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12 mol/L,
故答案为:HA?H++A-;10-12;
(3)加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液中c(HA)、c(A-)减小,溶液温度不变,离子积常数不变,则溶液中c(OH-)增大;
A.加水稀释促进HA电离,n(H+)增大、n(HA)减小,溶液体积相同,所以$\frac{c({H}^{+})}{c(HA)}$增大,故错误;
B.加水稀释促进HA电离,n(A-)增大、n(HA)减小,溶液体积相同,所以$\frac{c(HA)}{c({A}^{-})}$减小,故正确;
C.温度不变,水的离子积常数不变,所以c(H+)与c(OH-)的乘积不变,故错误;
D.加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液温度不变,离子积常数不变,则溶液中c(OH-)增大,故错误;
故选B;
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合,二者恰好反应生成BA,BA为强碱弱酸盐,酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),但其水解程度较小,结合电荷守恒得c(B+)>c(A-),所以离子浓度大小顺序是c(B+)>c(A-)>c(OH-)>c(H+),其水解方程式为 A-+H2O?HA+OH-
,故答案为:碱性; A-+H2O?HA+OH-;c(B+)>c(A-)>c(OH-)>c(H+);
(5)常温下pH=12的BOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L,硫酸氢钠是强酸酸式盐,其完全电离生成钠离子、氢离子和硫酸根离子,相当于强酸性溶液,硫酸氢钠溶液中c(H+)=0.01mol/L,混合溶液pH=11>7,混合溶液中$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,则混合溶液呈碱性,混合溶液中c(OH-)=$\frac{0.01mol/L×0.1L-0.01mol/L×xL}{(0.1+x)L}$=0.001mol/L,x=81.8mL,
故答案为:81.8.
点评 本题考查弱电解质的电离、盐类水解、酸碱混合溶液定性判断等知识点,为高频考点,正确判断电解质强弱是解本题关键,难点是混合溶液有关计算,注意:离子积常数只与温度有关,与溶液酸碱性及浓度无关.


科目:高中化学 来源: 题型:选择题
| A. | 若甲烧杯中溶液浓度为0.1 mol•L-1,则乙烧杯中溶液浓度大于0.01 mol•L-1 | |
| B. | 向甲烧杯中加入等体积pH=(14-a)的NaOH溶液后,溶液显碱性 | |
| C. | 两溶液中水电离出的OH-浓度:10C甲(OH-)<C乙(OH-) | |
| D. | 取等体积甲乙溶液分别与适量NaOH溶液完全中和,所得溶液的pH:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向100mL0.1mol•L-1的Na2CO3溶液中滴加含0.01molCH3COOH的醋酸溶液CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积均匀混合4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 等物质的量的FeBr2与Cl2反应(已知:Br2+2Fe2+═2Fe3++2 Br-,Cl2+2Br-═Br2+2Cl-):2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 向NaAlO2溶液中通入过量CO2的反应:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后所得溶液的溶质是强酸弱碱盐 | |
| B. | 弱酸溶液和强碱溶液反应 | |
| C. | 强酸溶液和弱碱溶液反应 | |
| D. | 一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 二氧化碳的分子式: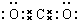 | |
| B. | Cl-的结构示意图: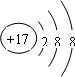 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | 质子数为53、中子数为78 的碘原子:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
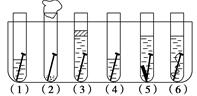 取6根铁钉、6支洁净试管及其他材料,按图所示准备.
取6根铁钉、6支洁净试管及其他材料,按图所示准备.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | H2CO3?2H++CO32 | ||
| C. | NaHSO4═Na++HSO4- | D. | CH3COOH?H++CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com