
一定量的氢气与一定量的氯气反应,所得混合物用100ml 3.00mol/L的NaOH溶液(密度为1.2g/ml)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol(溶液中只含NaCl和NaClO两种溶质)。则下列有关说法不正确的是
A.原NaOH溶液的质量分数为10.0%
B.所得溶液中Cl-的物质的量为0.25 mol
C.参加反应的氢气的物质的量为0.1 mol
D.所用氯气和参加反应的氢气的物质的量之比为2﹕3
科目:高中化学 来源: 题型:阅读理解
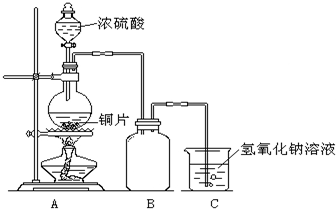 某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
| ||
| ||
| m |
| 64 |
| m |
| 64 |
| m |
| 32 |
| m |
| 32 |
| V |
| 22.4×0.012 |
| V |
| 22.4×0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原NaOH溶液的质量分数为10.0% | B、所得溶液中Cl-的物质的量为0.25mol | C、参加反应的氢气的物质的量为0.1mol | D、所用氯气和参加反应的氢气的物质的量之比为2﹕3 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省中山市高二下学期期末考试化学试卷(带解析) 题型:填空题
(15分)氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等。请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2 (g)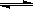 2NH3 (g) △H1
2NH3 (g) △H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H= ;若不能,说明理由:
。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g) + 3H2(g) 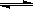 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
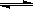 2NH3(g) △H<0 。
2NH3(g) △H<0 。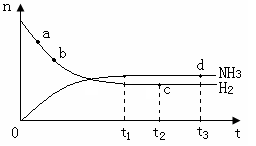
 CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0| 容器 | c(CO2) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OCH3) /mol·L-1 | c(H2O) /mol·L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省乐山市高三第二次调查研究考试理科综合试卷(化学部分) 题型:选择题
一定量的氢气与一定量的氯气反应,所得混合物用100ml 3.00mol/L的NaOH溶液(密度为1.2g/ml)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol(溶液中只含NaCl和NaClO两种溶质)。则下列有关说法不正确的是
A.原NaOH溶液的质量分数为10.0%
B.所得溶液中Cl-的物质的量为0.25 mol
C.参加反应的氢气的物质的量为0.1 mol
D.所用氯气和参加反应的氢气的物质的量之比为2﹕3
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
高中阶段常用化学反应方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com