
·ÖĪö £Ø1£©øł¾ŻøĒĖ¹¶ØĀɵÄŌĄķĄ“ÅŠ¶Ļ£»
£Ø2£©øł¾ŻøĒĖ¹¶ØĀÉĄ“ÅŠ¶Ļø÷²½·“Ó¦Ö®¼äµÄ¹ŲĻµ£»
£Ø3£©øł¾ŻøĒĖ¹¶ØĀÉ£¬ÓÉŅŃÖŖČČ»Æѧ·½³ĢŹ½³ĖŅŌŹŹµ±µÄĻµŹż½ųŠŠ¼Ó¼õ£¬·“Ó¦ČČŅ²³ĖŅŌĻąÓ¦µÄĻµŹż½ųŠŠĻąÓ¦µÄ¼Ó¼õ£»
£Ø4£©Ź×ĻČŠ“³öFeO£Øs£©±»CO»¹Ō³ÉFeŗĶCO2µÄČČ»Æѧ·½³ĢŹ½CO£Øg£©+FeO£Øs£©=Fe£Øg£©+CO2£Øg£©”÷H£¬ĄūÓĆøĒĖ¹¶ØĀÉ¢Ł”Į3-£Ø¢Ū”Į2+¢Ś£©æɵƵ½øĆ»Æѧ·½³ĢŹ½£¬ŅŌ“Ė¼ĘĖć”÷H£®
½ā“š ½ā£ŗ£Ø1£©ÓÉøĒĖ¹¶ØĀÉæÉÖŖ£ŗČōŹĒŅ»øö·“Ó¦æÉŅŌ·Ö²½½ųŠŠ£¬Ōņø÷²½·“Ó¦µÄĪüŹÕ»ņ·Å³öµÄČČĮæ×ÜŗĶÓėÕāøö·“Ó¦Ņ»“Ī·¢ÉśŹ±ĪüŹÕ»ņ·Å³öµÄČČĮæĻąĶ¬£¬
¹Ź“š°øĪŖ£ŗµČÓŚ£»
£Ø2£©øł¾ŻøĒĖ¹¶ØĀÉ£¬·“Ó¦1=·“Ó¦2+·“Ó¦3”Į$\frac{1}{2}$+·“Ó¦4”Į$\frac{1}{2}$ĖłŅŌ”÷H1=”÷H2+$\frac{1}{2}$£Ø”÷H3+”÷H4£©£¬
¹Ź“š°øĪŖ£ŗ”÷H1=”÷H2+$\frac{1}{2}$£Ø”÷H3+”÷H4£©£»
£Ø3£©ŅŃÖŖ£ŗ¢ŁC£Øs£©+O2£Øg£©=CO2£Øg£©£»”÷H=-393.5kJ•mol-1
¢Ś2CO£Øg£©+O2£Øg£©=2CO2£Øg£©£»”÷H=-566kJ•mol-1
¢ŪTiO2£Øs£©+2Cl2£Øg£©=TiCl4£Øs£©+O2£Øg£©£»”÷H=141kJ•mol-1
øł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ł”Į2-¢Ś+¢ŪµĆTiO2£Øs£©+2Cl2£Øg£©+2C£Øs£©=TiCl4£Øs£©+2CO£Øg£©£¬
¹Ź”÷H=2”Į£Ø-393.5kJ•mol-1-£Ø-566kJ•mol-1£©+141kJ•mol-1=-80kJ•mol-1£¬
¹Ź“š°øĪŖ£ŗ-80kJ•mol-1£»
£Ø4£©¢ŁFe2O3£Øs£©+3CO£Øg£©=2Fe£Øs£©+3CO2£Øg£©£»”÷H=-25kJ/mol
¢Ś3Fe2O3£Øs£©+CO£Øg£©=2Fe3O4£Øs£©+CO2£Øg£©£»”÷H=-47kJ/mol
¢ŪFe3O4£Øs£©+CO£Øg£©=3FeO£Øs£©+CO2£Øg£©£»”÷H=+640kJ/mol
ŅĄ¾ŻøĒĖ¹¶ØĀÉ¢Ł”Į3-£Ø¢Ū”Į2+¢Ś£©µĆµ½£ŗ
6CO£Øg£©+6FeO£Øs£©=6Fe£Øg£©+6CO2£Øg£©”÷H=-66kJ/mol£»
µĆµ½ČČ»Æѧ·½³ĢŹ½ĪŖ£ŗCO£Øg£©+FeO£Øs£©=Fe£Øs£©+CO2£Øg£©”÷H=-1308kJ/mol£¬
¹Ź“š°øĪŖ£ŗCO£Øg£©+FeO£Øs£©=Fe£Øs£©+CO2£Øg£©”÷H=-1308kJ/mol£®
µćĘĄ ±¾Ģāæ¼²éøĒĖ¹¶ØĀÉ”¢·“Ó¦ČȵÄÓŠ¹Ų¼ĘĖć”¢ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“£¬ÄѶČÖŠµČ£¬×¢ŅāøĒĖ¹¶ØĀɵĥķ½āÓėČČ»Æѧ·½³ĢŹ½µÄŹéŠ“£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪŽĖ®ŅŅĖįŗĶŅŅ“¼¹²ČČÖĘČ”ŅŅĖįŅŅõ„ | |
| B£® | ½«±½ÖšµĪµĪČėÅØĻõĖįÖŠ£¬²¢ÓĆ·ŠĖ®Ō”¼ÓČČÖĘČ”Ļõ»ł±½ | |
| C£® | ½«ĶĖæŌŚ¾Ę¾«µĘÉĻ¼ÓČČŗó£¬Į¢¼“ÉģČĖĪŽĖ®ŅŅ“¼ÖŠ£¬ĶĖæ»Öø“ŌĄ“µÄŗģÉ« | |
| D£® | µķ·ŪÓĆĖį“ß»ÆĖ®½āŗóµÄČÜŅŗ¼ÓČėŠĀÖĘŅų°±ČÜŅŗ£¬Ė®Ō”¼ÓČČ£¬æÉ擵½ÓŠŅų¾µ³öĻÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C6H12O6£ØĘĻĢŃĢĒaq£©+6O2$\stackrel{Ćø}{”ś}$6CO2+6H2O | |
| B£® | CH3COOH+KOHØTCH3COOK+H2O | |
| C£® | A+BØTC+D£»”÷H£¼0 | |
| D£® | Ba£ØOH£©2•8H2OÓėNH4Cl·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČĖĆĒæÉŅŌĄūÓĆĻČ½ųµÄ»Æѧ¼¼ŹõŗĶÉč±øÖĘŌģŠĀµÄŌ×Ó | |
| B£® | ČĖĆĒæÉŅŌĄūÓĆ“ß»Æ¼ĮŹ¹Ė®±ä³ÉĘūÓĶ | |
| C£® | ČĖĆĒæÉŅŌĄūÓĆĻČ½ųµÄ¼¼ŹõŗĶÉč±øÖĘŌģŠĀµÄ·Ö×Ó | |
| D£® | »ÆѧæĘѧֻÄÜĶعżŹµŃ饓Ģ½ĢÖĪļÖŹµÄŠŌÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ś¢Ü | B£® | ¢Ś¢Ü¢Ż | C£® | ¢Ś¢Ū¢Ü¢Ż | D£® | ¢Ś¢Ü¢Ž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
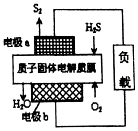
| A£® | µē¼«aĪŖµē³ŲµÄøŗ¼« | |
| B£® | µē¼«bÉĻ·¢ÉśµÄµē¼«·“Ó¦ĪŖO2+4H++4e-ØT2H2O | |
| C£® | ČōµēĀ·ÖŠĶعż2molµē×Ó£¬Ōņµē³ŲÄŚ²æŹĶ·Å632kJČČĮæ | |
| D£® | ČōÓŠ17gH2S²ĪÓė·“Ó¦£¬Ōņ»įÓŠ1molH+¾ÖŹ×ÓĤ½ųČėÕż¼«Ēų |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

| ĒāŃõ»ÆĪļ | Al£ØOH£©3 | Fe£ØOH£©3 | Cu£ØOH£©2 | Mn£ØOH£©2 |
| Ksp | 1.0”Į10-33 | 4.0”Į10-38 | 2.0”Į10-20 | 4.0”Į10-14 |
 £»”°¾»»Æ”±Ź±£¬¼ÓČė£ØNH4£©2SµÄ×÷ÓĆĪŖŹ¹Cu2+×Ŗ»ÆĪŖCuS³Įµķ£®
£»”°¾»»Æ”±Ź±£¬¼ÓČė£ØNH4£©2SµÄ×÷ÓĆĪŖŹ¹Cu2+×Ŗ»ÆĪŖCuS³Įµķ£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com