
| ||
| m |
| M |
| 8.7g |
| 87g/mol |
| ||
| 0.1mol×1 |
| 1 |
| 0.1mol×1 |
| 1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、足量的Cu与含有0.2mol H2SO4的浓硫酸共热可生成SO2为0.1 NA |
| B、78 g 苯含有碳碳双键的数目为3NA |
| C、标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.1NA |
| D、25℃,1LpH=1的硫酸溶液中含有的H+数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
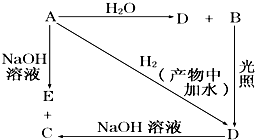 常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
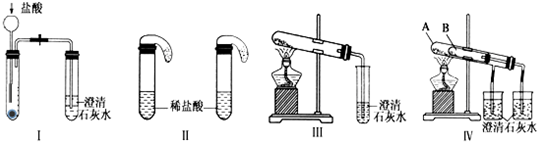
查看答案和解析>>
科目:高中化学 来源: 题型:
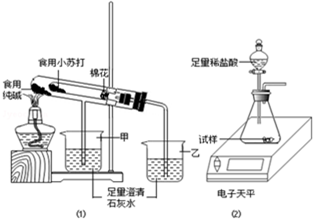 某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.| 名称 | 食用纯碱 | 食用小苏打 |
| 主要成分 | Na2CO3 | NaHCO3 |
| 酸碱性 | 水溶液显碱性 | 水溶液显碱性 |
| 热稳定性 | 受热不分解 | 270℃时完全分解为碳酸钠、二氧化碳、水 |
| 称量项目 | 称量时间 | 质量/g |
| 试样 | 11.0 | |
| 装置+稀盐酸 | 160.0 | |
| 装置+稀盐酸+试样 | 反应开始后20s | 167.0 |
| 装置+稀盐酸+试样 | 反应开始后30s | 166.6 |
| 装置+稀盐酸+试样 | 反应开始后90s | 166.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
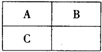 A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的是( )
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的是( )| A、B与C均存在同素异形体 |
| B、X的种类比Y的多 |
| C、沸点:A的氢化物小于C的氢化物 |
| D、A的原子半径最小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com