
【题目】已知还原性I﹣>Fe2+>I2,在水溶液中I2可被Cl2氧化为IO3﹣,向含溶质amol的FeI2溶液中通入bmol Cl2,充分反应(不考虑单质与水的反应).
(1)当a=2b时,反应后的粒子浓度之比:c(Fe2+):c(I﹣):c(Cl﹣)=________。
(2)若反应后溶液中I2与IO3﹣的物质的量为1:1,则反应中转移的电子_______mol(用含a的代数式表示)。
【答案】 1:1:1 19a/3
【解析】还原性强弱顺序为:I->Fe2+>I2,所以不断通Cl2的过程中,依次发生以下氧化还原反应:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、5Cl2+I2+6H2O=2IO3-+12H++10Cl-。
(1)当a=2b时,则碘离子的物质的量为:4bmol,而bmol Cl2消耗2bmol的I-,生成2bmolCl-,所以反应后的粒子的物质的量之比:n(Fe2+):n(I-):n(Cl-)=2b:2b:2b=1:1:1,因此c(Fe2+):c(I﹣):c(Cl﹣)=1:1:1,故答案为:1:1:1;
(2)若反应后溶液中I2与IO3-的物质的量为1:1,说明亚铁离子完全被氧化,amol的FeI2中![]() amol的碘离子氧化成
amol的碘离子氧化成![]() amol碘单质,另外
amol碘单质,另外![]() amol的碘离子氧化成
amol的碘离子氧化成![]() amol碘酸根离子,所以转移电子的物质的量为:
amol碘酸根离子,所以转移电子的物质的量为: ![]() amol×1+
amol×1+![]() amol×6+amol×1=
amol×6+amol×1=![]() amol,故答案为:
amol,故答案为: ![]() a。
a。


科目:高中化学 来源: 题型:
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需_____________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏大的操作是___________(填序号)
a. 转移溶液时,没有等溶液冷却至室温 b.量取浓硫酸时,俯视刻度线
c.当容量瓶中液体占容积2/3左右时,未振荡摇匀 d. 定容时俯视刻度线
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42- 或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是________________。
(6)通SO2气体时,其化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对甲烷、乙烯性质的描述中,不正确的是( )
A.乙烯能使溴水褪色
B.在一定条件下,乙烯自身加聚生成聚乙烯
C.甲烷能使酸性高锰酸钾溶液褪色
D.在光照条件下,甲烷与氯气发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
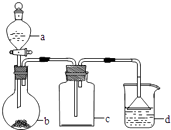
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是( )
A.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B.制铁:以铁矿石为原料,CO还原得铁
C.制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁
D.制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50 mL稀盐酸和1 g碳酸钙反应的实验数据:
实验序号 | 碳酸钙状态 |
| 溶液温度/℃ | 碳酸钙消失所需时间/s | |
反应前 | 反应后 | ||||
1 | 粒状 | 0.5 | 20 | 39 | 400 |
2 | 粉末 | 0.5 | 20 | 40 | 60 |
3 | 粒状 | 0.6 | 20 | 41 | 280 |
4 | 粒状 | 0.8 | 20 | 40 | 200 |
5 | 粉末 | 0.8 | 20 | 40 | 30 |
6 | 粒状 | 1.0 | 20 | 40 | 120 |
7 | 粒状 | 1.0 | 30 | 50 | 40 |
8 | 粒状 | 1.2 | 20 | 40 | 90 |
9 | 粒状 | 1.2 | 25 | 45 | 40 |
分析并回答下列问题:
(1)本反应属于 (填“吸热”或“放热”)反应,反应的离子方程式为 。
(2)实验6和7表明, 对反应速率有影响, 反应速率越大,能表明同一规律的实验还有
(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是 。
(4)本实验中影响反应速率的其他因素还有 ,能表明这一规律的实验序号是1、2与 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)
B. NaOH(aq)+HI(aq)=NaI(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(中和热)
C. S(s)+![]() O2(g)=SO3(g) ΔH=-296.8 kJ·mol-1(燃烧热)
O2(g)=SO3(g) ΔH=-296.8 kJ·mol-1(燃烧热)
D. 2NO2=O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如下:
![]()
下列有关叙述不合理的是
A. 纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当
B. 纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C. 在反应①中环丙胺的作用可能是促进氯化铁水解
D. 反应②的化学方程式是6FeOOH +CO=2Fe3O4+3H2O+CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com