
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 102 | 74 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.X原子的电子层数比Y原子的电子层数多 |
| B.Y的氢化物的沸点比X的氢化物的沸点高 |
| C.X的气态氢化物比Y的气态氢化物稳定 |
| D.Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若把HF分子写成H2F分子,违反了共价键的饱和性 |
B.若把碳的轨道式写成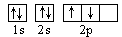 则违反了泡里不相容原理 则违反了泡里不相容原理 |
| C.若把Be的基态电子排布式写成1s22s12p1 则违反了能量最低原理 |
D.若把氧的轨道式写成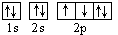 则违反了洪特规则 则违反了洪特规则 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.它们都能与水反应生成氢气和碱 |
| B.所形成的阳离子的氧化性随原子序数递增依次减弱 |
| C.它们在空气中燃烧都生成R2O(R指碱金属) |
| D.碱金属中密度最小、熔沸点最高的是锂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:HClO4>HBrO4>HIO4 | B.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C.稳定性:PH3 > H2S> HCl | D.还原性: F-< Cl-< I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
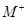 、
、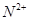 、
、 、
、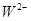 具有相同的电子层结构。(用推断出的元素符号表示)
具有相同的电子层结构。(用推断出的元素符号表示)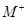 、
、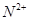 、
、 、
、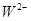 的离子半径由大到小的顺序是? ?。
的离子半径由大到小的顺序是? ?。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
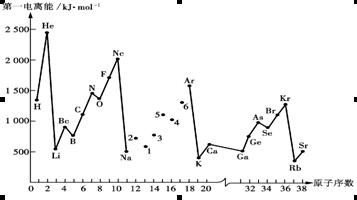
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com