
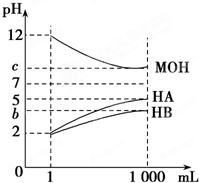
 某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:分析 (1)将pH=2的稀释1000倍,如果是强酸,稀释后溶液的pH为5;如果是弱酸,稀释过程中促进弱酸电离,稀释后溶液的pH小于5,将pH=12的MOH碱溶液稀释1000倍,若c=9,说明MOH是强碱;
(2)若c=9,说明MOH是强碱,则将pH=2的HB与pH=12的MOH等体积混合后,反应后HB又电离出氢离子溶液显酸性;
(3)将pH=12的MOH碱溶液稀释1000倍,若c=9,说明MOH是强碱,酸或碱都抑制水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大;
(4)HA是强酸、HB是弱酸,常温下,取pH=2的HA、HB各100mL,向其中分别加入适量的Zn粒,反应过程中HB继续电离出氢离子,要使反应后溶液pH仍然相等,说明与HA反应的锌质量小于HB.
解答 解:(1)将pH=2的稀释1000倍,如果是强酸,稀释后溶液的pH为5;如果是弱酸,稀释过程中促进弱酸电离,稀释后溶液的pH小于5,根据图象知,HA是强酸、HB是弱酸,将pH=12的MOH碱溶液稀释1000倍,若c=9,说明MOH是强碱,
故答案为:强;弱;强;
(2)若c=9,说明MOH是强碱,HB为弱酸,则将pH=2的HB与pH=12的MOH等体积混合后,反应后HB又电离出氢离子溶液显酸性,
故答案为:酸;
(3)将pH=12的MOH碱溶液稀释1000倍,若c=9,说明MOH是强碱,酸或碱都抑制水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大,稀释后的溶液中,HB中氢离子浓度大于HA,HA中氢离子浓度等于MOH中氢氧根离子浓度,所以抑制水电离程度:MOH=HA<HB,所以溶液中水电离出氢离子浓度大小顺序是MOH=HA>HB;
故答案为:MOH=HA>HB;
(4)HA是强酸、HB是弱酸,常温下,取pH=2的HA、HB各100mL,向其中分别加入适量的Zn粒,反应过程中HB继续电离出氢离子,要使反应后溶液pH仍然相等,说明HA中参加反应的氢离子物质的量小于HB,所以与HA反应的锌质量小于HB,故答案为:<.
点评 本题考查了酸碱混合溶液定性判断、弱电解质的电离等知识点,会根据稀释过程中判断电解质强弱是解本题关键,再结合弱电解质的性质分析解答,知道酸或碱中水电离出氢离子或氢氧根离子的计算方法,为学习难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液与K3[Fe(CN)6]混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| B. | 向饱和食盐水中加入少量浓盐酸,看到溶液振荡,溶液变浑浊 | |
| C. | 某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大 | |
| D. | 处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | CH3COONa溶液中:c(CH3COO-)>c(Na+) | |
| C. | 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 常温下,0.1mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Au-e-═Au+ | B. | O2+2H2O+4e-═4OH- | ||
| C. | Au-e-+2CN-═Au(CN)2- | D. | 2H2O+2e-═2OH-+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法判断该溶液中是否含有K+ | |
| B. | 该溶液中一定含有K+、SiO32-,可能含有CO32- | |
| C. | 该溶液中无SO32-,一定含有CO32- | |
| D. | 该溶液中可能含有K+和CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com