

| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
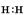 (1分)
(1分)

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.11.2g | B.5.6g | C.2.8g | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
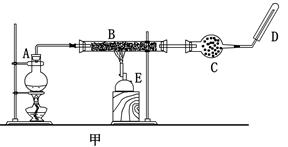
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.①② | B.②⑨ | C.⑨④ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许。 | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。 | |
| 3 | 。 | ,则甲是 ,乙是 。 ,则甲是 ,乙是 。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属与盐溶液间的反应一定是置换反应 |
| B.能与酸反应的氧化物一定是碱性氧化物 |
| C.1 1H2和2 1H2的物理性质略有差异,化学性质几乎完全相同 |
| D.常见金属铁和铝在工业上是由热还原法制得的 |
查看答案和解析>>
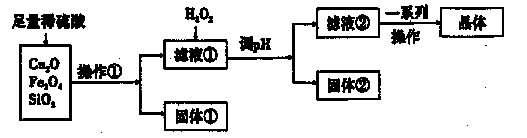
科目:高中化学 来源:不详 题型:实验题
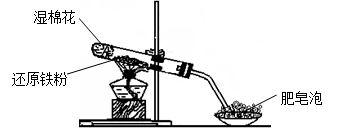
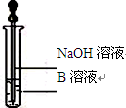
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com