

分析 (1)硫酸钴溶液和草酸铵溶液发生复分解反应生成难溶的草酸钴,根据元素守恒和电荷守恒书写离子方程式;
(2)根据平衡移动原理可知,升高温度平衡向吸热的反应方向移动,据此可判断反应的△H;根据
$v=\frac{△c}{t}$计算反应速率,转化率=$\frac{已转化的量}{起始的量}$×100%,平衡常数等于生成物浓度的系数次幂之积除以反应物浓度的系数次幂之积,据此答题;
(3)Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15,对于同种类型的沉淀,Ksp越小,越难溶,则在滴加氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,当Co2+开始沉淀时,溶液中存在两个溶解平衡:Co(OH)2?CO2++2OH-,Ni(OH)2?Ni2++2OH-,根据Ksp[Co(OH)2]计算出此时溶液中c(OH-),则可计算出此时溶液中剩下的镍离子浓度,最终得出溶液中$\frac{c(Co{\;}^{2+})}{c(Ni{\;}^{2+})}$的值;
(4)依据图阳极是铁,故阳极上铁放电生成FeO42-结合碱性环境来写出电极方程式;
解答 解:(1)硫酸钴溶液和草酸铵溶液发生复分解反应生成难溶的草酸钴,反应的离子方程式为C₂O?2-+Co2+=CoC₂O?↓,
故答案为:C₂O?2-+Co2+=CoC₂O?↓;
(2)根据平衡移动原理可知,升高温度平衡向吸热的反应方向移动,根据图可知,升高温度,c[Fe(SCN)2+]的值减小,所以△H<0,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45mol/L,则达到平衡时的平均反应速率v(SCN-)=v[Fe(SCN)2+]=$\frac{0.45}{5}$mol•L-1•S-1=0.09mol•L-1•S-1,参加反应的Fe3+的物质的量为0.45mol,所以Fe3+的转化率=$\frac{0.45}{0.5}$×100%=90%,平衡时各物质的浓度为:c(Fe3+)=c(SCN-)=0.05mol/L,c[Fe(SCN)2+]=0.45mol/L,所以平衡常数K=$\frac{0.45}{0.05×0.05}$=180,
故答案为:<;0.09;90%;180;
(3)Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15,对于同种类型的沉淀,Ksp越小,越难溶,则在滴加氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,
当Co2+开始沉淀时,溶液中存在两个溶解平衡:CO(OH)2?CO2++2OH-,Ni(OH)2?Ni2++2OH-,
根据Ksp[Co(OH)2]计算出此时溶液中c(OH-),c(OH-)=$\sqrt{\frac{K{\;}_{SP[Co}{\;}_{(OH){\;}_{2}}]}{c(Co{\;}^{2+})}}$=$\sqrt{\frac{6.0×10{\;}^{-15}}{0.6}}$=10-7mol/L,
则溶液中剩下的镍离子浓度c(Ni2+)=$\frac{K{\;}_{SP}[Ni(OH){\;}_{2}]}{c{\;}^{2}(OH{\;}^{-})}$=$\frac{2.0×10{\;}^{-15}}{(10{\;}^{-7})^{2}}$=0.2mol/L,溶液中$\frac{c(Co{\;}^{2+})}{c(Ni{\;}^{2+})}$=$\frac{0.6mol/L}{0.2mol/L}$=3.0,
故答案为:3.0;
(4)阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe+8OH--6e-=FeO42-+4H2O,
故答案为:Fe+8OH--6e-=FeO42-+4H2O.
点评 本题考查了铁及其化合物的知识,涉及反应热的判断、转化率、平衡常数的计算、难溶电解质的计算、电极反应的书写等,综合性强,有一定难度,应注意基础知识的灵活运用.


科目:高中化学 来源: 题型:解答题
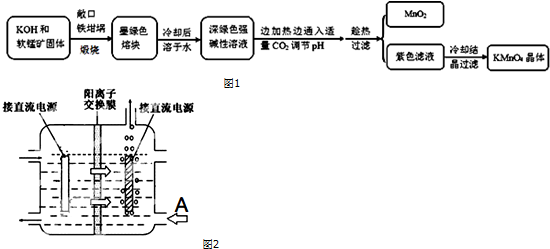
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关 | |
| C. | SO2的水溶液能够导电,所以SO2是电解质 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶质用蒸馏水溶解后,未冷却即转移至容量瓶中并定容 | |
| B. | 未洗涤溶解溶质用的烧杯及玻璃棒 | |
| C. | 定容时仰视刻度线观察液面 | |
| D. | 容量瓶中原来含有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的电子式: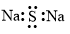 | |
| B. | HClO4的电离方程式:HClO4?H++ClO4- | |
| C. | 乙酸的结构简式:C2H4O2 | |
| D. | Mg2+的结构示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com