
【题目】SO2是空气污染物 ,含有SO2 的尾气需处理后才能排放,有多种方法可除 去尾气中SO2。回答下列问题:
(1)氨水吸收法。利用氨水吸收烟气中的SO2, 其相关反应的主要热化学方程式如下:
SO2(g)+NH 3 H2O(aq)=NH4HSO3(aq) △H1=akJmol-1;
NH 3 H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(1)△H2= b kJ mol-1;
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4 (aq)△H3 =ckJ mol-1;
则反应 2SO2(g)+4 NH 3 H2O(aq)+ O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=___________kJ mol-1(用含a、b、c的代数式表示)。
(2)热解气还原法。已知CO与SO2 在加热和催化剂作用 下生成生成S(g)和CO2。
①该反应的化学方程式为__________。
②在T °C时,向lL恒容的密闭容器中入充1 mol CO、0.5molSO2发生上述反应(S为气态).5min时达到化学平衡,平衡时测得SO2的转化率为90 %,则 0 ~ 5 mi n 内 反应的平均速率v(SO2)=__________。此温度下该反应的平衡常数 K1=_______。下列选项中能够说明该反应已经达到平衡状态的是_____(填字母)。
a.体系的压强保持不变
b.混合气体的密度保持不变
c.混合气体的平均摩尔质量保持不变
d.单位时间内CO消耗的物质的量与 SO2 生成的物质的量之比为2:1
(3)氧化锌吸收法。配制ZnO悬浊液(含少量 MgO、CaO)在吸收塔中封闭循环脱硫。发生的主要反应为ZnO十SO2 = ZnSO3(s).吸收过程中,测得pH、吸收效率η随 时间t的变化如图a所示。溶液中含硫元素微粒各组分浓度之比如图b所示。
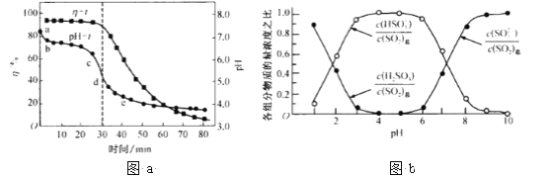
①已知纯ZnO的悬浮液 pH 约为6.8,判断在pH-t曲线cd 段发生的主要反应的离子方程式为____________。
②SO2的吸收效率η随 pH 降低而减小的原因是____________。
【答案】2a+2b+c 2CO+SO2 S(g)+2CO2 0.09mol·L—1·min—1 729 d ZnSO3+SO2+H2O=Zn2+ +2HSO
S(g)+2CO2 0.09mol·L—1·min—1 729 d ZnSO3+SO2+H2O=Zn2+ +2HSO![]() pH 降低,c(H+)增大,ZnSO3溶解
pH 降低,c(H+)增大,ZnSO3溶解
【解析】
根据盖斯定律求相关反应的反应热;根据信息写出反应并配平;根据化学反应速率和平衡常数的表达式,求出相关物理量进行相关的计算;根据化学平衡状态的特征分析判断化学平衡状态的依据;
(1)利用氨水吸收烟气中的SO2, 其相关反应的主要热化学方程式如下:
①SO2(g)+NH3 H2O(aq)=NH4HSO3(aq)△H1=akJmol-1;
②NH3 H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(1)△H2= b kJ mol-1;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=ckJ mol-1;
根据盖斯定律可知,①2+②2+③可得2SO2(g)+4 NH3 H2O(aq)+ O2(g)=2(NH4)2SO4(aq)+2H2O(l),则反应2SO2(g)+4 NH3 H2O(aq)+ O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=2△H1+2△H2+△H3=(2a+2b+c) kJ mol-1。
(2)①CO与SO2在加热和催化剂作用 下生成生成S(g)和CO2,该反应的化学方程式为2CO+SO2 S(g)+2CO2。
S(g)+2CO2。
②在T °C时,向lL恒容的密闭容器中入充1 mol CO、0.5molSO2发生上述反应,5min时达到化学平衡,平衡时测得SO2的转化率为90 %,则 0 ~ 5 mi n 内SO2的变化量为0.45mol,则CO、S(g)、2CO2的变化量为0.9 mol、0.45 mol、0.9 mol,CO、SO2、S(g)、2CO2的平衡浓度分别为0.1mol/L、0.05mol/L、0.45mol/L、0.9mol/L。 0 ~ 5 mi n 内反应的平均速率v(SO2)=![]() 0.09mol·L—1·min—1。此温度下该反应的平衡体系中,平衡常数 K1=
0.09mol·L—1·min—1。此温度下该反应的平衡体系中,平衡常数 K1= 729。
729。
a. 反应前后气体的分子数相同,故压强在反应过程中始终不变,当恒容的密闭容器中体系的压强保持不变时,不能判断是否达到化学平衡状态;
b.根据质量守恒定律可知,恒容的密闭容器中气体的质量不变、体积不变,故在反应过程中混合气体的密度保持不变,无法据此判断反应是否达到平衡状态;
c.在反应过程中,气体的总物质的量不变,气体的质量也不变,故混合气体的平均摩尔质量保持不变,不能据此判断反应是否达到化学平衡状态;
d.单位时间内CO消耗的物质的量与SO2生成的物质的量之比为2:1,说明正反应速率和逆反应速率相等,可以说明反应已经达到平衡状态。
综上所述,能够说明该反应已经达到平衡状态的是d。
(3)①由图象可知,在pH-t曲线bc段,溶液的pH变化较小,可知该阶段主要发生ZnO+SO2= ZnSO3;在pH-t曲线cd 段,溶液的pH变小较快,可以推断ZnSO3转化为易溶于水的酸式盐Zn(HSO![]() )2,该反应的离子方程式为ZnSO3+SO2+H2O=Zn2++2HSO
)2,该反应的离子方程式为ZnSO3+SO2+H2O=Zn2++2HSO![]() 。
。
②由上面分析可知,ZnSO3可以转化为易溶于水的酸式盐Zn(HSO![]() )2。由图b知,HSO
)2。由图b知,HSO![]() 的水溶液显酸性,SO2在酸性溶液中的溶解度较小,所以,SO2的吸收效率η随 pH 降低而减小的原因是:pH 降低,c(H+)增大,ZnSO3溶解。
的水溶液显酸性,SO2在酸性溶液中的溶解度较小,所以,SO2的吸收效率η随 pH 降低而减小的原因是:pH 降低,c(H+)增大,ZnSO3溶解。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】一种免疫调节剂,其结构简式如图所示,关于该物质的说法不正确的是
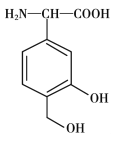
A. 属于芳香族化合物,分子式为C9H11O4N
B. 可以发生的反应类型有:加成反应、取代反应、氧化反应、聚合反应
C. 分子中所有碳原子有可能在同一平面上
D. 1mol该调节剂最多可以与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下述正确的是( )
A.64gSO2含有硫原子数为2NA
B.NA个氧气分子和NA个氢气分子的质量比等于16∶1
C.28g氮气所含的原子数目为NA
D.标准状况下,22.4L的水含有 NA个水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下 ,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol L-1的盐酸:Na+、Cu2+、SO![]() 、NO
、NO![]()
B.0. 1 mol L-1的氨水:K+、Al3+、Cl、CH3COO-
C.0. 1 mol L-1的Fe(NO3)3溶液: H+、K+、Cl-、I-
D.0.1 mol L -1的Na2SO3溶液:NH![]() 、Na+、ClO-、SO
、Na+、ClO-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 为短周期主族元素,其常见化合价与原子半径的关系如图所示。已知四种元素中只有 Y 与 Z 同周期,下列说法正确的是( )
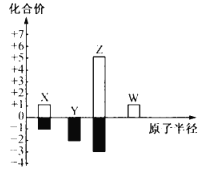
A.简单氢化物的稳定性:Y<Z
B.X、Y、Z 可组成盐类化合物
C.X 的氧化物中不可能含非极性键
D.W 的最高价氧化物对应水化物为弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:
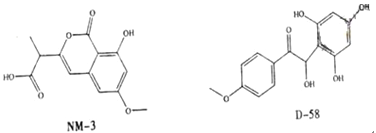
关于NM-3和D-58的叙述,错误的是
A.都能与![]() 溶液反应,原因不完全相同
溶液反应,原因不完全相同
B.都能与溴水反应,原因不完全相同
C.都不能发生消去反应,原因相同
D.遇![]() 溶液都显色,原因相同
溶液都显色,原因相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粘合剂M的合成路线如下图所示:
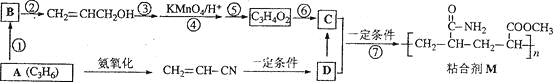
完成下列填空:
1)写出A和B的结构简式。
A___________B_______________
2)写出反应类型。反应⑥______________反应⑦______________
3)写出反应条件。反应②______________反应⑤______________
4)反应③和⑤的目的是____________________。
5)C的具有相同官能团的同分异构体共有________________种。
6)写出D在碱性条件下水解的反应方程式。
____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①![]()
![]()
②![]()
![]()
下列判断不正确的是( )
A.①中的![]() 为固态,②中的
为固态,②中的![]() 为气态
为气态
B.①的反应物总能量比②的反应物总能量高
C.反应①的产物与反应②的产物热稳定性相同
D.1mol 固态碘完全升华会吸热35.96kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com