
分析 Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+4H2O,Cu化合价由0价升高到+2价,所以反应物Cu是还原剂,4HNO3参加反应,其中2HNO3中N化合价由+5降低到+4,2HNO3中N化合价不变,所以反应物HNO3既作氧化剂又作酸性,转移电子数为2,据此结合方程式分析计算.
解答 解:(1)Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+4H2O,4HNO3参加反应,其中2HNO3中N化合价由+5降低到+4,2HNO3中N化合价不变,所以反应物HNO3既体现氧化性又体现酸性,故答案为:氧化性和酸性;
(2)反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,一个Cu原子失2个电子,所以Cu是还原剂;HNO3→NO2,N元素由+5价→+4价,一个HNO3分子得一个电子,所以HNO3是氧化剂;其得失电子数为2,所以其转移电子数为2,即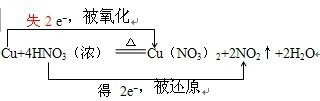 ,
,
故答案为: ;
;
(3)由反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,当有2mol HNO3参加反应时,则标准状况下生成NO2气体的体积为1mol×22.4L/mol=22.4L,故答案为:22.4L.
点评 本题考查氧化还原反应,为高频考点,侧重于基本概念、电子转移表示方法及其计算的考查,难度不大,注意对基础知识的理解掌握.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 常温时水溶液中的溶解度:Na2CO3<NaHCO3 | |
| C. | 与稀盐酸反应快慢:Na2CO3<NaHCO3 | |
| D. | 相同物质的量时二者与盐酸反应,消耗盐酸:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁门上焊接铜块既美观,又能防腐蚀 | |
| B. | 古代青铜文物在干燥环境中的腐蚀比潮湿环境中快 | |
| C. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| D. | 可将地下输油管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2 (g)+O2(g)═2H2O(g)△H1; 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H1; 2CO(g)+O2(g)═2CO2(g)△H2 | |
| D. | $\frac{1}{2}$ H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g)△H1;H2(g)+Cl2(g)═2HCl(g)△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com