
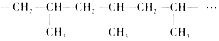 其重复结构单元即它的链节是
其重复结构单元即它的链节是 .
.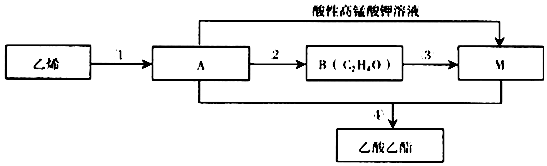
 ,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O. CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.
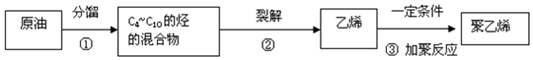
CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收. 分析 (1)原油中各组分沸点的不同可用分馏分离;
(2)根据碳原子数超过4个的烷烃分子存在同分异构体分析;
(3)聚烯烃的合成反应与聚乙烯的相同都是加成聚合反应,即加聚反应;
(4)乙烯通过反应①生成A,A被酸性高锰酸钾溶液氧化生成M,A与M发生酯化反应生成乙酸乙酯,则A为乙醇、M为乙酸,A通过反应②生成B,B通过反应③生成M,则B为乙醛,据此进行解答.
解答 解:(1)利用石油中各成分的沸点不同,将它们分离出来的方法叫分馏,所以分馏是利用原油中各组分的沸点不同进行分离的过程,
故答案为:沸点;
(2)分子式为C4H10的烃有正丁烷和异丁烷两种结构:CH3(CH2)2CH3和CH(CH3)3,则C4~C10的烃由于存在同分异构现象,所以所含的烃的种类超过7种,
故答案为:分子式为C4H10的烃有两种结构:CH3(CH2)2CH3和CH(CH3)3,所以C4~C10的烃因存在同分异构现象,其所含的烃超过7种;
(3)步骤③中,聚烯烃的合成反应与生成聚乙烯的反应类型相同,都是加成聚合反应,简称加聚反应; 中重复的结构单元为
中重复的结构单元为 ,
,
故答案为:加聚反应; ;
;
(4)乙烯通过反应①生成A,A被酸性高锰酸钾溶液氧化生成M,A与M发生酯化反应生成乙酸乙酯,则A为乙醇、M为乙酸;A通过反应②生成B,B通过反应③生成M,则B为CH3CHO,
I.反应①为乙烯与水反应生成乙醇,该反应为加成反应,故答案为:加成反应;
Ⅱ.乙烯结构简式为CH2=CH2,官能团名称碳碳双键,根据分析可知,A为CH3CH2OH,所含官能团的电子式 ,B为CH3CHO,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:碳碳双键;
,B为CH3CHO,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:碳碳双键; ;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
Ⅲ.反应④为乙醇与乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法为通入饱和碳酸钠溶液吸收;
CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法为通入饱和碳酸钠溶液吸收;
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;通入饱和碳酸钠溶液吸收.
CH3COOCH2CH3+H2O;通入饱和碳酸钠溶液吸收.
点评 本题考查了有机推断,题目难度中等,涉及有机物的推断、有机物结构与性质、有机反应类型判断、有机反应方程式书写等知识,明确常见有机物结构与性质为解答根据.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. |  检查装置气密性 | |
| B. |  实验室制氨气 | |
| C. | 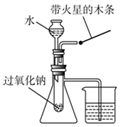 验证过氧化钠与水反应即生成氧气又放热 | |
| D. |  分离苯和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
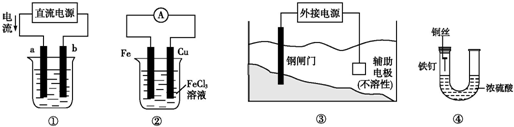
| A. | 用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Fe+2Fe3+═3Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的负极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
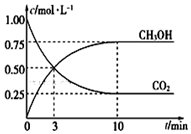 根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1
根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 min内,用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率其比值是1:1:1 | |
| C. | 2 min时间内反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 2 min内用C表示的反应速率v (C)是0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
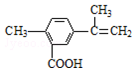
| A. | 在一定条件下,能发生取代、氧化、酯化反应 | |
| B. | 1 mol该物质最多可与2 molNa反应 | |
| C. | 1 mol该物质最多可与4 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁片、石墨棒,稀硫酸 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,CuSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com