
| A. | 在水玻璃中通入过量二氧化碳,加热蒸干,最终得到混合物 | |
| B. | 铁件镀铜的目的是利用电化学防腐原理保护铁件不受腐蚀 | |
| C. | 制糖工业用活性炭脱色和制纸工业用次氯酸盐漂白纸浆的原理相同 | |
| D. | 使红色石蕊试纸变蓝的溶液中能大显存在Na+、Fe3+、NO3-、Cl- |
分析 A、向硅酸钠溶液中通入过量的CO2,CO2和Na2SiO3反应生成NaHCO3、H2SiO3;
B、铁件镀铜的目的是利用电解的原理,在铁表面生成铜;
C、依据活性炭与次氯酸漂白原理解答;
D、使红色石蕊试纸变蓝的溶液呈碱性.
解答 解:A、向硅酸钠溶液中通入过量的CO2,CO2和Na2SiO3反应生成NaHCO3、H2SiO3,所以最终得到混合物,故A正确;
B、铁件镀铜的目的是利用电解的原理,在铁表面生成铜,而不是防腐,故B错误;
C、活性炭脱色是利用其吸附性,次氯酸盐漂白是利用次氯酸的强氧化性,故C错误;
D、使红色石蕊试纸变蓝的溶液呈碱性,碱性溶液中铁离子不能存在,故D错误;
故选A.
点评 本题为综合题,考查了元素化合物的知识、生产中的应用,熟悉相关物质的性质是解题关键,注意盐类水解规律、物质漂白原理,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成与氮的氧化物无关 | |
| B. | 钙、铁、碘都是人体内必需的微量元素 | |
| C. | 白酒中混有少量塑化剂,可通过过滤除去 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 仅①②③④ | C. | 仅①③④⑤ | D. | 仅①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
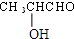
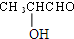 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$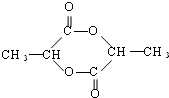 +2 H2O
+2 H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol | B. | 4 mol | C. | 5 mol | D. | 6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com