
| A. | 一个D2O分子中所含中子数为8 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
分析 A.D原子中含有1个中子,O原子中含有8个中子;
B.非金属性越强,对应氢化物的稳定性越强;
C.非金属性越强,最高价含氧酸的酸性越强;
D.金属性越强,最高价氧化物对应水合物的碱性越强.
解答 解:A.一个D2O分子中所含中子数为:1×2+8=10,故A错误;
B.非金属性Cl>S>P,则氢化物的热稳定性:HCl>H2S>PH3,故B正确;
C.非金属性:Si<C<N,则最高价氧化物对应水合物的酸性强弱为:H2SiO3<H2CO3<HNO3,故C正确;
D.金属性:K>Na>Mg,最高价氧化物对应水合物的碱性强弱为:KOH>NaOH>Mg(OH)2,故D正确;
故选A.
点评 本题考查元素周期律的应用,题目难度不大,明确元素周期律内容为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 固体氯化钠不导电,所以氯化钠是非电解质 | |
| B. | 铜丝能导电,所以铜是电解质 | |
| C. | 氯化氢水溶液能导电,氯化氯是电解质 | |
| D. | SO2的水溶液能导电,所以SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}O$、${\;}_{8}^{17}O$、${\;}_{8}^{18}O$互为同素异形体 | |
| B. | 正戊烷、异戊烷、新戊烷互为同系物 | |
| C. | O2与O3互为同位素 | |
| D. | CH2Cl2不存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前使用的元素周期表中,最长的周期含有18种元素 | |
| B. | 不存在质子数相等,核外电子数也相等的分子a和离子b(a、b为代号) | |
| C. | 金属元素和非金属元素形成的化合物在熔融状态下一定能导电 | |
| D. | 共价化合物中,原子的最外层电子数只能是2或8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
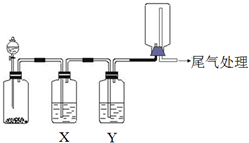
| 选项 | 实验目的 | X中试剂 | Y中 试剂 |
| A | 粗锌与稀盐酸制取 收集干燥的氢气 | 饱和食盐水 | 浓硫酸 |
| B | Na2SO3固体与较浓盐酸 反应制取收集干燥SO2 | 饱和Na2SO3溶液 | 浓硫酸 |
| C | 铜与稀硝酸制取并收集 纯净干燥的NO | 水 | 浓硫酸 |
| D | CaCO3和稀盐酸制取收集 纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 书写共价化合物的电子式只需把结构式中的一个单键改成一对电子即可 | |
| B. | 已知  ,可见,成键的一方不提供电子也可能形成化学键 ,可见,成键的一方不提供电子也可能形成化学键 | |
| C. | 将某种化合物溶于水,若能导电说明这种化合物是离子化合物 | |
| D. | 只要是离子化合物其熔点就比共价化合物的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 250 mL 1 mol•L-1FeCl3溶液中,阴、阳离子总数为NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol HCN分子中含有的π键数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | 放热1940kJ | B. | 吸热1940kJ | C. | 放热485kJ | D. | 吸热485kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | W元素的非金属性比Z元素的非金属性弱 | |
| B. | Z和X能以共价键结合形成一种无机非金属材料 | |
| C. | Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | |
| D. | X的气态氢化物是同主族元素气态氢化物中最稳定的,原因是其分子间有氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com