
分析 ①取此溶液少许,加入足量盐酸无明显现象,说明溶液中不存在银离子、碳酸根离子;
②另取少许加入足量浓氢氧化钠溶液,有白色沉淀生成,说明溶液中一定存在镁离子,一定不会存在碳酸根离子、氢氧根离子;
③将②中沉淀过滤,取滤液微热,有无色刺激性气味气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,溶液中一定存在铵离子,一定不会存在氢氧根离子,再根据溶液呈电中性判断,溶液中一定存在硫酸根离子,一定不会存在钡离子.
解答 解:由①取此溶液少许,加足量盐酸无明显现象,可知溶液中不存在Ag+、CO32-;
由②另取少许加入足量浓NaOH溶液,有白色沉淀生成,可知溶液中一定存在Mg2+,一定不会存在与镁离子反应的离子:OH-、CO32-;
由③将②中沉淀过滤,取滤液微热,有无色刺激性气味气体放出,该气体能使湿润的红色石蕊试纸变蓝,可知生成的气体为氨气,溶液中一定存在NH4+,
再根据溶液呈电中性可知,溶液中一定存在阴离子SO42-,则一定不存在与硫酸根离子反应的离子:Ba2+,Na+无法确定.
根据以上分析可知,该溶液中一定存在的离子有:NH4+、Mg2+ SO42-;一定不存在的离子为:Ba2+、Ag+ OH-、CO32-,
故答案为:NH4+、Mg2+ SO42-;Ba2+、Ag+ OH-、CO32-.
点评 本题考查了离子反应、常见的离子检验方法,题目难度中等,注意熟练掌握常见离子之间发生的反应现象及离子检验的方法,明确某些离子的特征反应,如铝离子、亚铁离子的特征反应.


科目:高中化学 来源: 题型:选择题
| A. | 滤纸,烧杯,试管夹,漏斗,玻璃棒 | |
| B. | 烧杯,酒精灯,试管,漏斗 | |
| C. | 铁架台(附铁圈),烧杯,漏斗,玻璃棒,滤纸 | |
| D. | 铁架台(附铁圈),烧杯,漏斗,玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaCl(Na2CO3) | 盐酸 | 蒸馏 |
| B | CO2(CO) | O2 | 点燃 |
| C | Fe (Al) | FeSO4 | 过滤 |
| D | 乙醇(水) | CaO | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示,下列说法正确的是( )| A. | 原溶液一定含有Na2SO4 | |
| B. | 反应最后形成的溶液中的溶质为NaCl | |
| C. | 原溶液中一定含有的阴离子是OH-、CO32-、AlO2-、SiO32- | |
| D. | 原溶液中含有CO32-与AlO2-的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化镁与稀硝酸反应:O2-+2H+═H2O | |
| B. | 向稀硫酸溶液中撒入铁粉 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 向碳酸钙中加入盐酸 CO32-+2H+=H2O+CO2↑ | |
| D. | 向氢氧化钠溶液中通入少量二氧化碳 2OH-+CO2=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
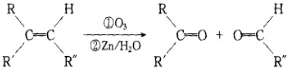
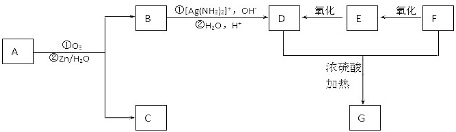
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com