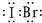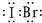卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)基态溴原子的电子排布式为______.
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为______.
(3)气态氟化氢中存在二聚分子(HF)2,这是由于______.
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为______.
(5)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为______.
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为______(填序号).
【答案】
分析:(1)根据溴的原子的质子数为35,由能量最低原理来书写电子排布式;
(2)根据相对分子质量来判断范德华力,再比较物质的沸点;
(3)利用F的电负性及氢键来解释;
(4)根据价层电子对结构模型来分析I
3+的空间构型;
(5)RbICl
2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,利用半径来分析晶格能相对较大的卤化物;
(6)非金属性越强,则对应最高价含氧酸的酸性就强,同种元素的含氧酸,利用非羟基氧个数来判断酸性.
解答:解:(1)溴的原子的质子数为35,核外电子数为35,由能量最低原理其电子排布式为[Ar]3d
104s
24p
5,故答案为:[Ar]3d
104s
24p
5;
(2)因相对分子质量BrI>ICl>Cl
2 ,则范德华力BrI>ICl>Cl
2 ,即沸点BrI>ICl>Cl
2 ,故答案为:BrI>ICl>Cl
2 ;
(3)因F的电负性最大,则HF分子中存在氢键则形成二聚分子,故答案为:HF分子间形成氢键;
(4)因I
3+可看成II
2+,孤电子对数由

(a-xb)=

(7-1-2×1)=2,σ键数为2,则I
3+的空间构型为V形,故答案为:V形;
(5)RbICl
2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,氯离子的半径小于碘离子的半径,则RbCl的离子键长小于RbI的离子键长,则RbCl的晶格能较大,
则A为RbCl,故答案为:RbCl;
(6)因非金属性Cl>Br>I,非金属性越强,则对应的最高价氧化物的酸性越强,则①的酸性最强,在②③中都是碘元素的含氧酸,非羟基氧个数越多,酸性越强,则酸性到为②>③,故答案为:①②③.
点评:本题以卤素化学为信息来考查原子结构及物质的性质,明确沸点的比较方法、氢键对物质性质的影响、非金属性的比较、孤电子对数的确定是解答的关键,本题中(4)是解答的难点.

 (a-xb)=
(a-xb)= (7-1-2×1)=2,σ键数为2,则I3+的空间构型为V形,故答案为:V形;
(7-1-2×1)=2,σ键数为2,则I3+的空间构型为V形,故答案为:V形;

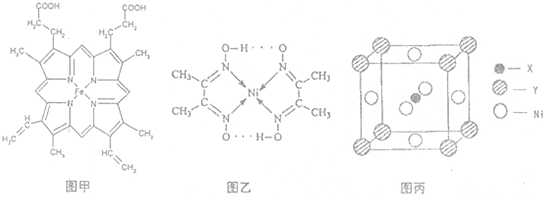
 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为