
(12分) 未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
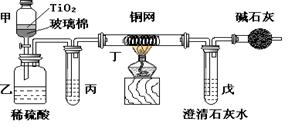
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)甲中反应的离子方程式为__________________________________
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是______(填字母)
a.饱和食盐水 b.饱和NaHCO3溶液 c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是____________________________装有碱石灰的干燥管的作用是____________________________
(4)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于________请说明该测得值与实际处理的百分率相比偏高还是偏低_________?简要说明可能的原因__________________________________。
(5)请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂)
_________________________________________________________________________
(1)CN-+ClO- CNO-+Cl-
CNO-+Cl-
(2)a
(3)除去Cl2 防止空气中CO2进入戊中影响测定准确度
(4)82% ①装置乙、丙、丁中可能滞留有CO2;
②CO2产生的速度较快未与戊中的澄清石灰水充分反应;③Cl2、HCl在丙、丁中未吸收完全。(三点中任意答两点即可,每答对一点给1分,共2分)
(5)建议一:不将甲中溶液一次全部加入乙中,改为分次加入,控制CO2的产生速度;
建议二:乙中瓶塞改为三孔塞,增加的那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多的与Ca(OH)2反应。
建议三:将戊中澄清石灰水改为浓度较大的NaOH溶液,反应结束后向戊中加入足量CaCl2后测沉淀质量。等等(三点中任意答一点即可)
【解析】
试题分析:(1)甲中发生反应的离子为CN-、ClO-,离子方程式为CN-+ClO- CNO-+Cl- 。
CNO-+Cl- 。
(2)丙中的试剂主要是用来除去HCl,且同时不产生新的杂质气体,故选a。
(3)丁中加热铜丝,其主要是与Cl2反应,除去Cl2,防止影响后续实验。
(4)根据关系式:
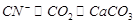
26 100
x 0.82g
 , x=0.2132g,
, x=0.2132g,
被处理的百分率
(5)对于此题的解答,可由其误差入手,排除误差就可以提高精确度。
考点:离子方程式;实验评价;产率计算
点评:本题主要考查了“离子方程式”、“产率的计算”以及“实验评价”等内容,属于难度较大的综合题。
①对实验装置的解答,应从气体的流向入手,考虑气体每经过一个装置发生的反应。
②对于实验方案的设计与评价,可从实验原理、原料、环保等方面入手。
③对于实验题的计算,尤其是涉及多步反应的计算,应根据质量守恒定律找出关系等式,避免书写过多的方程式,导致计算失误。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com