
 N�ļ�����946 kJ��mol��H��H�ļ���Ϊ436 kJ��mol��N��H�ļ���Ϊ391 kJ��mol����ݴ�д���ϳɰ���Ӧ���Ȼ�ѧ����ʽ ��
N�ļ�����946 kJ��mol��H��H�ļ���Ϊ436 kJ��mol��N��H�ļ���Ϊ391 kJ��mol����ݴ�д���ϳɰ���Ӧ���Ȼ�ѧ����ʽ �� ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g) ��H =��92.4 kJ��mol-1�����¶ȡ��ݻ���ͬ��2���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
2NH3(g) ��H =��92.4 kJ��mol-1�����¶ȡ��ݻ���ͬ��2���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�| ���� | ����1 | ����2 |
| ��Ӧ��Ͷ����ʼ̬ | 1mol N2��3mol H2 | 2mol NH3 |
| NH3��ƽ��Ũ��/mol��L-1 | cl | c2 |
| ��Ӧ�������仯 | �ų�a kJ | ����b kJ |
| ��ϵѹǿ/Pa | p1 | p2 |
| ��Ӧ��ת���� | ��1 | ��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 mZ(g)����H����a kJmol��1(a>0)�����мס������ݻ�����ҹ̶����ܱ��������ڱ��ָ��¶Ⱥ㶨�������£����ܱ���������ͨ��2 mol X��1 mol Y���ﵽƽ��״̬ʱ���ų�����b kJ�����ܱ���������ͨ��1 mol X��0.5 mol Y���ﵽƽ��ʱ���ų�����c kJ����b>2c����a��b��m��ֵ���ϵ��ȷ����
mZ(g)����H����a kJmol��1(a>0)�����мס������ݻ�����ҹ̶����ܱ��������ڱ��ָ��¶Ⱥ㶨�������£����ܱ���������ͨ��2 mol X��1 mol Y���ﵽƽ��״̬ʱ���ų�����b kJ�����ܱ���������ͨ��1 mol X��0.5 mol Y���ﵽƽ��ʱ���ų�����c kJ����b>2c����a��b��m��ֵ���ϵ��ȷ����| A��m��4 | B��a��b | C��a< | D��m��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)����H<0���ڲ�ͬ�¶ȣ�T1��T2���£�����Z�����ʵ���n�뷴Ӧʱ��t�Ĺ�ϵ��ͼ��ʾ���������ж�����ȷ���ǣ� ��
2Z(g)����H<0���ڲ�ͬ�¶ȣ�T1��T2���£�����Z�����ʵ���n�뷴Ӧʱ��t�Ĺ�ϵ��ͼ��ʾ���������ж�����ȷ���ǣ� ��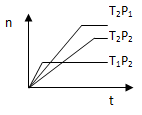
| A��T1��T2��P1��P2������ | B��T1��T2��P1��P2���� |
| C��T1��T2��P1��P2������ | D��T1��T2��P1��P2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ӧ2A(g) + B(g) =" 3C" (s) + D(g)��һ�����������Է����У�˵���÷�Ӧ�Ħ�H<0 |
| B�������£���pH��4�Ĵ�����Һϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ����� |
| C�������£�H2CO3���Ӳ����ܴ�����pH��8�ļ�����Һ�� |
| D���ںϳɰ���ҵ�У�����NH3����������Ӧ���ʣ����ԭ��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC(g)�ڲ�ͬ�¶�(T)��ѹǿ(P)�£�������C����������C%�ı仯��������й��ڸ�����Ӧ��ЧӦ������ʽ��A��B��C�Ļ�ѧ���������ж��У���ȷ���ǣ� ��
pC(g)�ڲ�ͬ�¶�(T)��ѹǿ(P)�£�������C����������C%�ı仯��������й��ڸ�����Ӧ��ЧӦ������ʽ��A��B��C�Ļ�ѧ���������ж��У���ȷ���ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 bB(��)��ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%����
bB(��)��ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%����| A��ƽ�����淴Ӧ�����ƶ��� | B������A��ת���ʼ����� |
| C������B���������������� | D����ѧ��������ϵa��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2��g��+ H2��g���ﵽƽ����CO2Ϊ0��6mol����ͨ��4molˮ�������ﵽƽ���CO2�����ʵ���Ϊ
CO2��g��+ H2��g���ﵽƽ����CO2Ϊ0��6mol����ͨ��4molˮ�������ﵽƽ���CO2�����ʵ���Ϊ| A������0��6mo | B������1mol |
| C������0��6mol��1mol | D������1mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2��g��+H2��g����H��0���Իش���������
CO2��g��+H2��g����H��0���Իش��������� ��
�� ����ʼʱc��CO��="2" mol��L-1��c��H2O��="3" mol��L-1���ﵽƽ��ʱCO��ת����Ϊ60%�����ڴ��¶��£��÷�Ӧ��ƽ�ⳣ��K=
����ʼʱc��CO��="2" mol��L-1��c��H2O��="3" mol��L-1���ﵽƽ��ʱCO��ת����Ϊ60%�����ڴ��¶��£��÷�Ӧ��ƽ�ⳣ��K= �鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com