
短周期元素Q、R、T、W在元素周期表中的位置如图所示,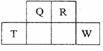 其中T所处的周期序数与主族序数相等。
其中T所处的周期序数与主族序数相等。
(1)T的原子结构示意图是_______。用化学方程式表示冶炼T单质常用原理是________。
(2)与同主族的某元素,其氢氧化物分子含有18个电子,该分子中存在的共价键的类型是___________。
(3)元素的非金属性:Q___W(填“强于”或“弱于”),用方程式简述其理由______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物。实验步骤:将盛有甲的试管倒扣在水槽中,____。
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
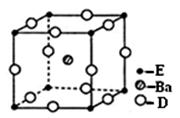 (4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置设计正确且能达到目的的是
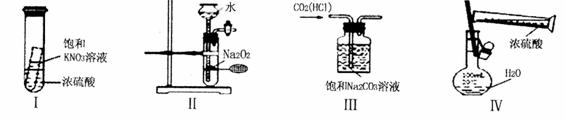
A.实验I:静置一段时间,小试管内有晶体析出 B. 实验II:制取氧气
C. 实验III除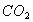 气体中的HCL D.实验IV:配制一定物质的量浓度的稀硫酸
气体中的HCL D.实验IV:配制一定物质的量浓度的稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 现将体积比为
现将体积比为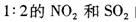 的混合气体置于密闭容器中发生上述反应,下列说明反应达到平衡状态的是
的混合气体置于密闭容器中发生上述反应,下列说明反应达到平衡状态的是
A. 体系压强保持不变 B. 混合气体颜色保持不变
C. 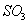 与
与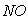 的体积保持不变 D.每消耗1mol
的体积保持不变 D.每消耗1mol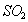 同时生成1mol
同时生成1mol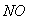
查看答案和解析>>
科目:高中化学 来源: 题型:
三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
(1)在如图所示装置中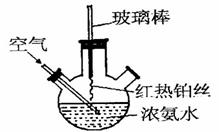 ,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中
,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中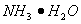 的电离程度____(填“变大”、“变小”或“不变”)
的电离程度____(填“变大”、“变小”或“不变”)
(2)实验室用下图所示装置制备氨基甲酸铵(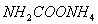 ),其反应化学方程式:
),其反应化学方程式:
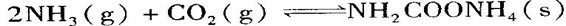
该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
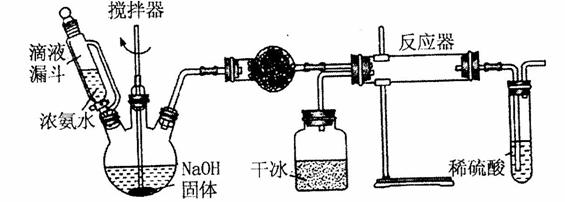
①写出加入药品之前实验操作的要点_______;反应中若有水存在则生成碳酸氢铵的化学方程式是________________________。
②干燥管中盛放的药品是______。简述左侧三颈瓶装置制取氨气的原理________。
③对比碳酸盐和酸的反应制取 ,该实验利用干冰升华产生
,该实验利用干冰升华产生 气体的有优点有_____.
气体的有优点有_____.
④有同学认为该实验装置存在安全问题,请问可能面临的安全问题是________。
⑤氨基甲酸氨可用作肥料,其肥效比尿素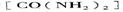 _______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质二混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
_______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质二混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
①H2O(g)====H2O(l) ΔH=- Q 1 kJ·mol-1
②C2H5OH(g)====C2H5OH(l) ΔH=- Q 2 kJ·mol-1
③C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1
下列判断正确的是( )
A.酒精的燃烧热为Q3 kJ
B.若使23 g液态酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q1-0.5Q2+0.5Q3) kJ
C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化
D.由反应③可知1 mol C2H5OH(g)的能量高于2CO2(g)和3H2O(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素周期表的说法不正确的是 ( )
A.第15列某元素能与其他元素化合形成碱性气体
B.第2列元素中肯定没有非金属元素
C.第17列的第一种元素的原子序数为9
D.短周期中能与强碱反应产生H2的金属元素位于第ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。

根据上图回答下列问题:
P和Cl2反应生成PCl3的热化学方程式是________________________________
________________________________________________________________________。
PCl5分解成PCl3和Cl2的热化学方程式是_________________________________
________________________________________________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________,P和Cl2一步反应生成1 mol PCl5的ΔH4____ΔH3(填“大于”、“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com