
| X | Y | ||
| W | Z | ||
| T |
| A、T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
| B、X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| C、由X、Y和氢三种元素形成的化合物中只有共价键 |
| D、物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 |


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、一定条件下,金属钠可以成为绝缘体 |
| B、一定条件下,水在20℃时能凝固成固体 |
| C、用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒 |
| D、几千万年前地球上一条恐龙体内的某个原子可能在你的身体里 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3 | B、1:2 |
| C、1:1 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
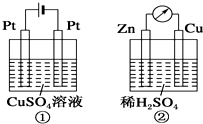 如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A、产生气体的体积:①>② |
| B、溶液的pH变化:①增大,②减小 |
| C、电极上析出固体物质的质量:①>② |
| D、电极反应式:①的阴极:Cu2++2e-═Cu,②的负极:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在熔融电解质中,O2-向负极定向移动 |
| B、电池的总反应是:2C4H10+13O2═8CO2+10H2O |
| C、通入空气的一极是正极,电极反应为:O2+4e-═2O2- |
| D、通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-═4CO2↑+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O |
| 浓H2SO4 |
| △ |
| Mg |
| 无水乙酸 |
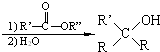
 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式: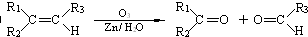
| BBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Na、Mg、Al的物质的量x | x<
|
| ③ | ④ | ||||
| 产生H2的体积 | ① | ② | V(Na)>V(Mg)=V(Al) | V(Na)=V(Mg)=V(Al) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com