
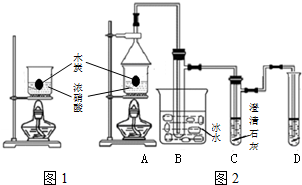
 浓硝酸是一种常见的酸,加热或见光易分解生成NO2.某实验小组欲探究碳与浓硝酸的反应情况.实验装置如图.回答下列问题:
浓硝酸是一种常见的酸,加热或见光易分解生成NO2.某实验小组欲探究碳与浓硝酸的反应情况.实验装置如图.回答下列问题:分析 (1)碳与浓硝酸反应生成二氧化碳、二氧化氮和水,反应中碳从0价变为+4价,据此答题;
(2)浓硝酸加热能分解产生红棕色气体二氧化氮;
(3)①常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,可以除去混合气体中的NO2;
②碳与硝酸反应会生成二氧化碳,所以C中澄清石灰水会变浑浊,反应尾气中会有少量的氮的氧化物,会污染空气,所以要用氢氧化钠溶液吸收;
③浓硝酸不稳定,加热易分解,为防止干扰,应该防止浓硝酸分解;
(4)碳与浓硝酸反应会产生氮的氧化物、浓硝酸加热也易挥发及发生分解产生氮的氧化物,都会污染空气,据此分析;
解答 解:(1)碳与浓硝酸反应生成二氧化碳、二氧化氮和水,反应方程式为C+4HNO3 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O,反应中碳从0价变为+4价,所以消耗1molC转移的电子是4mol,
故答案为:C+4HNO3 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;4;
(2)浓硝酸加热能分解产生红棕色气体二氧化氮,反应方程式为4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以图1装置进行实验,若有红棕色气体生成,不能说明碳与浓硝酸反应,
故答案为:不能;4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O;
(3)①常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,可以除去混合气体中的NO2,所以装置B的作用是除去混合气体中的NO2,
故答案为:除去混合气体中的NO2;
②碳与硝酸反应会生成二氧化碳,所以最能说明碳与硝酸反应的实验现象是C中澄清石灰水会变浑浊,反应的化学方程式是CO2+Ca(OH)2=CaCO3 ↓+H2O,反应尾气中会有少量的氮的氧化物,会污染空气,所以要用氢氧化钠溶液吸收,所以装置D中的试剂是氢氧化钠溶液,
故答案为:C中澄清石灰水会变浑浊;CO2+Ca(OH)2=CaCO3 ↓+H2O;氢氧化钠溶液;
③浓硝酸不稳定,加热易分解,为防止干扰,应该防止浓硝酸分解,但浓硝酸和碳的反应必须在加热条件下才能发生,所以要先将炭加热,再将碳投入冷的浓硝酸中,
故答案为:D;
(4)碳与浓硝酸反应会产生氮的氧化物、浓硝酸加热也易挥发及发生分解产生氮的氧化物,都会污染空气,所以装置1和装置2相比最大缺点是没有尾气吸收装置,
故答案为:没有尾气吸收装置.
点评 本题考查性质实验方案的设计,为高频考点,把握图中装置的作用、反应原理及实验技能为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| B. | 胶粒能透过滤纸,但不能透过半透膜 | |
| C. | 胶体与其他分散系的本质区别是丁达尔效应 | |
| D. | Al(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=12的溶液中,K+、Cl-、AlO2-、NH4+可以大量共存 | |
| B. | 由0.1 mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O?HA+OH- | |
| C. | 由0.1 mol•L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- | |
| D. | 在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:Fe3+、Al3+、I-、S2- | |
| B. | 水电离的H+浓度为 10-12mol•L-1的溶液中:Cl-、CO32-、NH4+、SO32- | |
| C. | 使石蕊变红的溶液中:Fe2+、MnO4-、Na+、SO42- | |
| D. | pH=11的溶液中:Na+、Cl-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
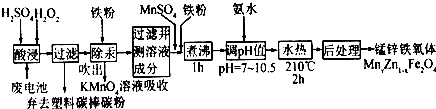
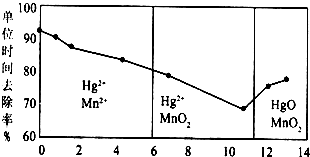
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
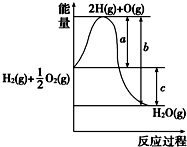
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、CO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•Lˉ1BaCl2溶液 | B. | 澄清石灰水 | ||
| C. | 稀盐酸 | D. | pH试纸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com