
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
【答案】D
【解析】
A.依据溴原子半径大于氯原子小于碘原子,原子半径越大,相应的化学键的键能越小分析,所以结合图表中数据可知432 kJ/mol>E(H-Br)>298 kJ/mol,A正确;
B.键能越大,断裂该化学键需要的能量就越大,形成的化学键越稳定,表中键能最大的是H-F,所以最稳定的共价键是H-F键,B正确;
C.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2→2H(g)△H=+436 kJ/mol,C正确;
D.依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断,△H=436kJ/mol+157kJ/mol-2×568kJ/mol=-543kJ/mol,H2(g)+F2(g) =2HF(g),△H=-543 kJ/mol ,D错误;
故合理选项是D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应原子利用率最高的是
A. 工业制漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B. 工业制备钠2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
C. 火法炼铜3Cu2S+3O2![]() 6Cu+3SO2
6Cu+3SO2
D. 现代石油工业采用银做催化剂生产环氧乙烷2CH2=CH2→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)向CuSO4溶液中逐滴滴加氨水至过量,过程中会先有沉淀生成,后沉淀逐渐溶解。
①写出沉淀溶解过程的离子方程式___________________。
②Cu2+基态时核外电子排布式为____________________。
③金属铜采取_____堆积。
④NH3分子空间构型为__________________。
(2)制备CrO2Cl2的反应为:K2Cr2O7+3CCl4=2KC1+2CrO2Cl2+3COC12↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为____________________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相似,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm,则熔点:NiO____FeO(填“>”、“<”或“=”)。
(4)Ni和La的合金是目前使用广泛的储氢材料。具有大容量、高寿命、耐低温等特点,在日本和中国己实现了产业化。该合金的晶胞结构如下图所示。

①该晶体的化学式为_______________________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是_________cm3(用含M、d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美日三名化学家利用钯作催化剂,将有机物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。下列说法正确的是( )
A.有机物中一定含有碳和氢两种元素
B.一定条件下,使用催化剂能提高反应物的平衡转化率
C.将有机物进行“缝合”可以不遵循原子守恒规律
D.将有机物进行“裁剪”需要破坏旧的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式为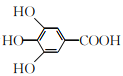 ,下列关于没食子酸的说法正确的是
,下列关于没食子酸的说法正确的是
A. 分子式为C7H7O5
B. 能发生加成反应,消去反应和取代反应
C. 1 mol没食子酸与足量的碳酸氢钠反应,生成4 mol CO2
D. 1 mol没食子酸与足量的钠反应,生成2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是
A. Zn为电池的负极
B. 正极反应式为![]() +10H++6e-===Fe2O3+5H2O
+10H++6e-===Fe2O3+5H2O
C. 该电池放电过程中电解质溶液碱性增大
D. 电池工作时OH-向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时,正逆反应速率为零
B. 若单位时间内生成xmol NO的同时,生成xmol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2υ(NH3)=3υ(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2=CH-CH2OH)可发生的化学反应有( )
①加成反应 ②氧化反应 ③置换反应 ④加聚反应 ⑤取代反应
A. ①②③ B. ②④⑤ C. ①②③④⑤ D. ①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com