
【题目】某实验小组同学模拟工业制碘的方法,探究ClO![]() 和I
和I![]() 的反应规律。实验操作及现象如下:
的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
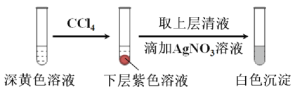
经检验,上述白色沉淀是AgCl。写出加入0.20 mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式: 。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设: NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2。
进行实验:
①取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。
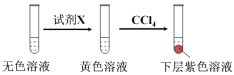
其中试剂X可以是 (填字母序号)。
a.碘水 b.MnO4溶液 c.NaHSO3溶液
② 有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30 mL 1.33 mol·L1 NaClO3溶液后,发现湿润的淀粉试纸没有明显变化。进行以上对比实验的目的是 ,进一步佐证实验4中生成了Cl2。
获得结论:NaClO3溶液用量增加导致溶液褪色的原因是 (用离子方程式表示)。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0 mol·L1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 。
②用离子方程式解释实验6的现象: 。
【答案】(1)ClO3-+6I-+6H+=Cl-+3I2+3H2O(2)①c
②排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰 2ClO3-+I2=Cl2↑+2IO3-
(3)①ClO3-和I-的反应规律与H+(或H2SO4)的用量有关
②6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O
【解析】
试题分析:(1)白色沉淀是AgCl,说明反应中有氯离子生成,因此氯酸钠的还原产物是氯离子,所以溶液中ClO3-和I-发生反应的离子方程式为ClO3-+ 6I-+ 6H+=Cl-+ 3I2 + 3H2O。
(2)①溶液由无色变为黄色,说明有碘单质生成,因此说明溶液中的碘酸根被还原为单质碘,选项中只有亚硫酸钠能被碘酸钾氧化,答案选c;
②由于碘易升华,所以进行以上对比实验的目的是排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰;根据以上分析可知NaClO3溶液用量增加导致溶液褪色的原因是由于氯酸根被生成的碘还原,而碘被氧化为碘酸根,反应的离子方程式为2ClO3- + I2=Cl2↑+ 2IO3-。
(3)①对比实验4和5中的实验现象可以获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关。②试管中溶液颜色是无色,说明没有碘生成,二淀粉碘化钾试纸变蓝色,说明有碘生成,因此反应中有氯气产生,将碘化钾氧化,所以反应的离子方程式为6ClO3- + 5I- + 6H+ =3Cl2↑ + 5IO3-+ 3H2O。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应_______________(用离子方程式表示)设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差 12 g,导线中通过__________mol 电子。
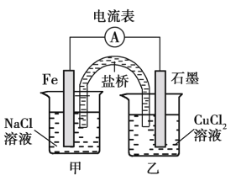
(2)其他条件不变,若将 CuCl2溶液换为 NH4Cl 溶液,石墨电极发生的电极反应为___________,这是由于 NH4Cl 溶液显_______________(填“酸性”、“碱性” 或“中性”)。用吸管吸出铁片附近的溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴 KSCN 溶液,溶液变红,继续滴加过量新制饱和氯水,溶液颜色褪去,同学们对此做了多种假设,某同学的假设:“溶液中的+3 价铁被氧化为更高价态。” 如果+3 价铁被氧化为 FeO42-,写出发生反应的离子方程式___________________。
(3)其他条件不变,若将盐桥换成弯铜导线与石墨连成的形装置如图所示,一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是____________,电极反应为__________;乙装置中石墨(Ⅰ)为__________(填“正”、 “ 负” 、 “ 阴”或“阳”)极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于pH = 2的盐酸,下列说法不正确的是
A. 溶液中c(H+)=1.0ⅹ10-2mol·L-1
B. 此溶液中由水电离出的c(OH-)=1.0ⅹ10-12mol·L-1
C. 加水稀释100倍后,溶液的pH=4
D. 加入等体积pH=12的氨水,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是( )
A.用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
B.用NaOH溶液与FeCl3溶液制备Fe(OH)3胶体
C.用品红和盐酸检验Na2SO3和Na2CO3
D.将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g)ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g)ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_________________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡状态的标志__________。
A.消耗1 mol N2同时生成1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
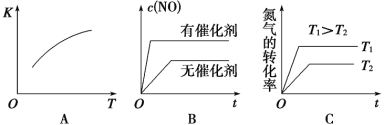
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,右图变化趋势正确的是________(填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数________。(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_____________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色。则以下说法正确的是

A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:

已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl]。
(1)写出物质A的名称: 。
(2)SnCl2用盐酸而不用水溶解的原因是: 。
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式: 。
(4)反应I生成的沉淀为SnO,写出该反应的化学方程式: 。
(5)实验室中“漂洗”沉淀的实验操作方法是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com