
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)??B(g)+C(g) ΔH=+85.1 kJ·mol-1
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
(1)升高温度、降低压强
(2)(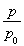 —1)×100% 94.1%
—1)×100% 94.1%
A(g)  B(g) + C(g)
B(g) + C(g)
0.10 0 0
0.10×(1-94.1%) 0.10×94.1% 0.10×94.1%
K=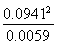 =1.5
=1.5
(3)①0.10×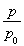 0.10×(2—
0.10×(2—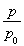 ) ②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
) ②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
【解析】 (1)要提高A的转化率,实际就是使平衡正向移动,根据方程式的特点正反应为气体物质的量增大的反应,且为吸热反应,可确定采取的措施。
(2)由阿伏加德罗定律推论可知,在恒温、恒容条件下,压强与物质的量成正比,将压强变化转化为物质的量变化,从而解决压强与转化率的关系。
A(g) B(g)+ C(g)
B(g)+ C(g)
假设起始物质
的量为1 mol 1 0 0
转化物质的量 a a a
反应到某时刻 1-a a a
所以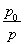 =
= ,解得a=(
,解得a=(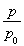 -1) mol。
-1) mol。
α(A)=(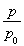 -1)×100%
-1)×100%
平衡时A的转化率=( -1)×100%≈94.1%。
-1)×100%≈94.1%。
(3)①与(2)思路相似,应用阿伏加德罗定律推论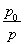 =
=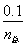 ,得n总=0.10×
,得n总=0.10×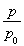 。
。
由方程式特点,应用差量法可知,反应过程增加的气体的物质的量,恰好等于反应的A的物质的量。
即:0.1-n(A)=n(总)-0.1
解得n(A)=0.2-0.1×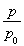
②从上表读出4 h时p=7.31
计算得n(A)=0.2-0.1×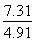 ≈0.051
≈0.051
依据此表中相邻两数据的差,即可得出规律。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:
| Y | V |
|
|
X |
|
|
| W |
Z为第四周期常见元素,该元素是人体血液中血红蛋白最重要的组成金属元素。V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成。下列说法正确的是( )。
A.原子半径:X>Y>V>W
B.X、W的质子数之和与最外层电子数之和的比值为2∶1
C.甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键
D.少量Z的单质与过量W的单质可化合生成ZW2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:选择题
物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能实现的是( )。
选项转化关系
A
B
C
D
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第7讲水溶液中的离子平衡练习卷(解析版) 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:

(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。

(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①________________________________________________________,
②________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32— CaCO3(s)+SO42—
CaCO3(s)+SO42—
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第7讲水溶液中的离子平衡练习卷(解析版) 题型:选择题
下列有关电解质溶液的说法正确的是( )。
A.在蒸馏水中滴加浓H2SO4,KW不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0;该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )。
MgO(s)+CO2(g)+SO2(g) ΔH>0;该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )。

选项xy
A温度容器内混合气体的密度
BCO的物质的量CO2与CO的物质的量之比
CSO2的浓度平衡常数K
DMgSO4的质量(忽略体积)CO的转化率
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第5讲化学反应与能量练习卷(解析版) 题型:填空题
(1)①根据下列图示,写出反应的热化学方程式___________________________。

②根据如图所示情况,判断下列说法中正确的是________。

A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41 kJ·mol-1
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是________________________________________。
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_________________________________。

a、b两条曲线产生区别的原因很可能是_________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第4讲物质结构元素周期律练习卷(解析版) 题型:选择题
)已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素。下列说法正确的是( )。
A.1 mol由元素A、B组成的化合物一定含有18 mol e-
B.元素C、D的最高价氧化物对应的水化物之间不可能发生反应
C.含D的盐溶液既可能显酸性,也可能显碱性
D.化合物AE与CE含有相同类型的化学键
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第15讲实验化学练习卷(解析版) 题型:实验题
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4—+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
A.稀硫酸 B.浓硝酸 C.稀硝酸 D.稀盐酸
(3)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)。

方案二 重量法 操作流程如下:

(4)步骤②中除用H2O2外还可以使用的物质是__________________________。
(5)步骤②是否可以省略________,理由是________________________________
_______________________________________。
(6)步骤④中一系列操作依次是:过滤、洗涤、________、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量________g(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com