
| A. | Na+ | B. | F- | C. | Al3+ | D. | O2- |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
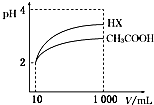 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:实验题
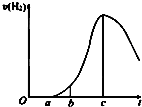 成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.
成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| M |
| A. | X、Y、Z、W形成的单质中都含有非极性共价键 | |
| B. | 元素最高价氧化物水化物对应的酸性大小W>Z,简单离子半径大小 关系:W>Z>X | |
| C. | M的氢化物的沸点高于X的,化合物M2O3有氧化性和还原性 | |
| D. | 有“海洋元素”美誉的元素与M同周期与W同主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、CO32- | B. | Ba2+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、NO3- | D. | Na+、Mg2+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
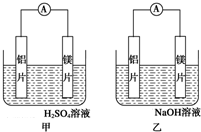 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com