


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL、1 mol/L NaCl溶液 |
| B、25 mL、3 mol/L NH4Cl 溶液 |
| C、75 mL、2 mol/L MgCl2溶液 |
| D、75 mL、2 mol/L FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠溶液均一稳定透明,不是分散系 |
| B、冰水混合物是一种分散系 |
| C、分散系有的是纯净物有的是混合物 |
| D、分散系都是混合物,按分散质和分散剂所处的状态,分散系的组合有9种方式 |
查看答案和解析>>
科目:高中化学 来源: 题型:

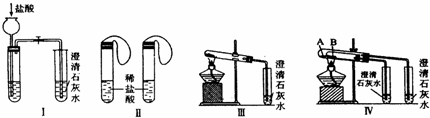
| A、实验一:验证二氧化碳密度大于空气,不支持燃烧 |
| B、实验二:探究燃烧需要的条件 |
| C、实验三:探究质量守恒定律 |
| D、实验四:测量空气中氧气所占的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
用50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用萃取的方法除去花生油中的水份 |
| B、用过滤的方法除去NaCl溶液中含有的少量淀粉 |
| C、用酒精萃取碘水中的碘 |
| D、用蒸馏的方法除去水中的不挥发的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸不能使酚酞溶液变红色 |
| B、0.1 mol?L-1的乙酸溶液pH>1 |
| C、乙酸能使紫色石蕊试液变红色 |
| D、乙酸和Na2CO3反应可放出CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com