
| A、在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存 |
| B、在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
| C、分别与等物质的量的HCl和CH3COOH反应时,消耗NaOH的物质的量相同 |
| D、由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
| A、①③⑤⑥ | B、②④ |
| C、②③④⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.1:2 | B、.1:5 |
| C、.5:1 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
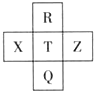 五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )
五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )| A、Z为Cl |
| B、非金属性:X<T |
| C、原子半径:R<T<Q |
| D、最高价氧化物的水化物的酸性:T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
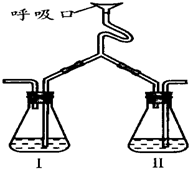 为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )
为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )| 瓶Ⅰ | 瓶Ⅱ | |
| A | Ca(OH)2 | NaOH |
| B | NaOH | NaOH |
| C | 稀HCl | Ca(OH)2 |
| D | NaOH | BaCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)电镀时,镀件与电源的
(1)电镀时,镀件与电源的
查看答案和解析>>
科目:高中化学 来源: 题型:
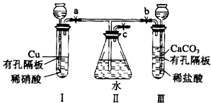 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com