
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是
A.X、Y元素的金属性Y>X
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.四种元素形成的单核离子半径由大到小的顺序为:Z3->W2->X2+>Y3+
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二下期末化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列各项叙述中正确的有( )。
①0.2 mol H2O2完全分解转移的电子数为0.4NA
②25 ℃、101 kPa下,16 g O3和O2混合气体中含有的氧原子数为NA
③将含0.1 mol FeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为0.1NA
④1 molFe溶于过量稀硝酸,电子转移数为3NA
⑤标准状况下,22.4 L CHCl3中含有的氯原子的数目为3NA
A.①②③ B.①②④⑤ C.①②③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期末化学试卷(解析版) 题型:选择题
双羟香豆素医学上用作抗凝剂,其结构如右图。下列有关双羟香豆素的说法正确的是( )
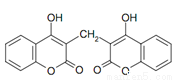
A.分子式为C19H10O6
B.遇Fe Cl3溶液能发生显色反应
Cl3溶液能发生显色反应
C.1 mol双羟香豆素最多能与含 4 mol氢氧化钠的水溶液完全反应
D.1 mol双羟香豆素最多能与 10 mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期末化学试卷(解析版) 题型:选择题
用一种试剂鉴别苯酚、1—己烯、碘化钾溶液、苯四种液体,应选用 ( )
A.盐酸 B.FeCl3溶液 C.溴水 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一下期末化学试卷(解析版) 题型:填空题
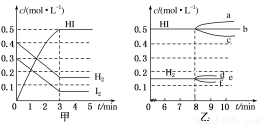
在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定条件下发生如下反应:H2(g)+I2(g) 2HI(g)ΔH<0,反应中各物质的浓度随时间变化情况如下图甲所示:
2HI(g)ΔH<0,反应中各物质的浓度随时间变化情况如下图甲所示:
(1)该反应的化学平衡常数表达式为________。
(2)根据图甲数据,反应开始至达到平衡时,平均速率v(HI)为________。
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K________(填“增大”“减小”或“不变”),HI浓度的变化正确的是________(用图乙中a~c的编号回答)。
②若加入I2,H2浓度的变化正确的是________(用图乙中d~f的编号回答)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一下期末化学试卷(解析版) 题型:选择题
向一固定体积的密闭容器中通入a mol N2O4气体,在密闭容器内发生反应:N2O4(g) 2NO2(g),达到平衡时再通入a mol N2O4气体,再次达到平衡时,与第一次达平衡时相比,N2O4的转化率( )
2NO2(g),达到平衡时再通入a mol N2O4气体,再次达到平衡时,与第一次达平衡时相比,N2O4的转化率( )
A.不变 B.增大 C.减小 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一下期末化学试卷(解析版) 题型:选择题
铝分 别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等,反应中消耗的HCl和NaOH物质的量之比为( )
别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等,反应中消耗的HCl和NaOH物质的量之比为( )
A .1:1 B.2:1 C.3:1 D.1:3
.1:1 B.2:1 C.3:1 D.1:3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期末化学试卷(解析版) 题型:选择题
下列有关金属腐蚀与防护的说法不正确的是( )
A.钢铁在弱碱性条件下发生电化学腐蚀的正极电极反应式:O2+2H2O+4e-===4OH-
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.牺牲阳极的阴极保护法,实际上“牺牲”的是原电池的负极
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二下期末化学试卷(解析版) 题型:填空题
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,写出AB2的电子式______________,分子中有______________个σ键,______________个π键。
(2)当n=3时,A单质形成的晶体属于______________晶体;
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是______________(用元素符号表示)。
(4)已知某红紫色络合物的组成为CoCl3•5NH3•H2O。该络合物中的中心离子钴离子在基态时核外电子排布简式为______________;
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com