
| A. | 苯酚与碳酸钠反应:2C6H5OH+CO32-→2C6H5O-+CO2↑+H2O | |
| B. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| D. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr |
分析 A.苯酚的酸性小于碳酸,二者反应生成碳酸氢根离子;
B.用稀HNO3溶解FeS固体,发生氧化还原反应生成硝酸铁、S、NO和水;
C.生成的铁离子具有氧化性,能够将碘离子乙醇碘单质;
D.溴化氢为强电解质,离子方程式中应该拆开.
解答 解:A.苯酚与碳酸钠反应生成碳酸氢根离子,正确的离子方程式为:C6H5OH+CO32-→C6H5O-+HCO3-,故A错误;
B.用稀HNO3溶解FeS固体,稀硝酸具有强氧化性,能够将亚铁离子、硫离子氧化,正确的离子反应为:NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故B错误;
C.Fe2O3溶于过量氢碘酸溶液中,二者发生氧化还原反应,反应的离子方程式为:Fe2O3+6H++2I-═2Fe2++I2+3H2O,故C正确;
D.二氧化硫通入溴水中,二者反应生成硫酸和溴化氢,溴化氢需要拆开,正确的离子方程式为:SO2+2H2O+Br2═4H++SO42-+2Br-,故D错误;
故选C.
点评 本题考查离子反应方程式书写,为高频考点,题目难度中等,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、氧化还原反应的离子反应考查.


科目:高中化学 来源: 题型:选择题
| A. | 阳极发生的反应只有:2Cl--2e-═Cl2↑ | |
| B. | 两极得到的气体均为混合气体 | |
| C. | 若Cu2+起始浓度为l mol•L-l,则C1-起始浓度为2 mol•L-1 | |
| D. | Cu2+的起始物质的量应小于0.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①②③ | B. | ③①②④ | C. | ①④③② | D. | ④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
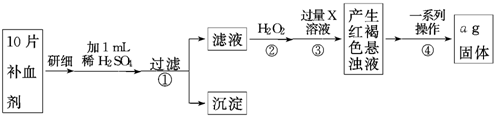
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2通FeSO4溶液中 | B. | NH3通入AlC13溶液中 | ||
| C. | CO2通入CaC12溶液中 | D. | SO2通人已酸化的Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
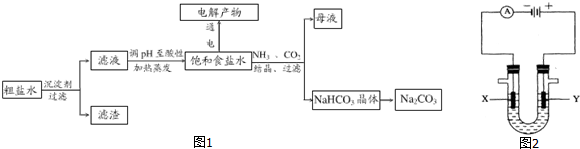
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04 mol•L-1 | B. | 0.5 mol•L-1 | C. | 0.05 mol•L-1 | D. | 0.04 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com