
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)写出③和⑥两种元素的元素符号:③________⑥_________;
(2)②和④两种元素形成的共价化合物的电子式是________________;
(3)元素②的气态氢化物的分子式为____________,
元素⑨最高价氧化物对应水化物的分子式为____________;
(4)④、⑤、⑧的原子半径由大到小的顺序为____________________;
(5) ②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____________;
(6) ②、③、⑦的气态氢化物中最不稳定的是___________(填化学式);
(7)用电子式表示H2O的形成过程___________________。
【答案】 N Al ![]() CH4 HClO4 Na>S>O H2SO4 >H2CO3>H2SiO3 SiH4;
CH4 HClO4 Na>S>O H2SO4 >H2CO3>H2SiO3 SiH4; ![]()
【解析】根据元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl;
(1)据分析可知③为N元素,⑥为Al元素;
(2)CO2是共价化合物,其电子式是![]() ;
;
(3)元素C的气态氢化物甲烷的分子式为CH4,元素Cl最高价氧化物对应水化物的分子式为HClO4;
(4)Na和S为同周期主族元素,核电荷数大原子半径小,而O与S是同族元素,核电荷数大原子半径大,则原子半径由大到小的顺序为Na>S>O;
(5)②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,H2CO3>H2SiO3,⑧为S,非金属S>C,元素的非金属性越强,对应的高价氧化物对应水化物的酸性越强,所以酸性:H2SO4>H2CO3,故答案为H2SO4>H2CO3>H2SiO3;
(6)C、N、Si的非金属性强弱顺序为N>C>Si,则它们气态氢化物中最不稳定的是SiH4;
(7)H2O为共价化合物,其电子式形成过程为![]() 。
。


科目:高中化学 来源: 题型:
【题目】将5mol·L-1 盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是
A.0.05mol/L B.0.25mol/L C.0.1mol/L D.0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X原子的最外层有6个电子,元素Y原子的最外层有3个电子,这两种元素形成的化合物的化学式可能是( )
A.X3Y2
B.X2Y
C.Y3X2
D.Y2X3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL0.1000 mol/L CH3COOH溶液所得滴定曲线如图。下列说法正确的是
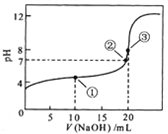
A. 点①所示溶液中:c(CH3COO-)+ c(OH-)=c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+) >c(OH-) >c(CH3COO-) > c(H+)
D. 滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) > c(H+)>c(Na+) >c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是
A.SO2的摩尔质量是64 g
B.1mol SO2中所含分子数约为6.02×1023个
C.1 mol SO2的质量是64 g / mol
D.常温常压下,1 mol SO2的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( ) ①NaHCO3 ②Al2O3③Al(OH)3 ④Al
A.③④
B.②③
C.①③④
D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com