
下列反应的离子于方程式正确的是
A.向氢氧化钠溶液中通入过量CO2 : CO2+2OH-= CO32-+ H2O
B.过量氯气通入碘化亚铁溶液中: Cl2+Fe2++2I-=2Cl-十Fe3+ +I2
C.氢氧化镁加入醋酸: Mg(OH)2+2H+=Mg2++2H2O
D.向碳酸氢钙溶液中加入过量的氢氧化钠:
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
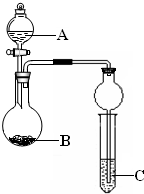 某同学设计了图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:
某同学设计了图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均为可溶于水的固体,组成它们的离子有
| 阳离子 | NH4+、Ag+、Mg2+、Ba2+、Al3+ |
| 阴离子 | Cl―、OH―、NO3―、CO32― |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B、C、D溶液反应最终均生成白色沉淀;
②C溶液与D溶液反应生成白色沉淀,同时放出无色气体;
③D溶液与适量E反应生成白色沉淀,加入过量E溶液,白色沉淀消失。
(1)据此推断它们是(填化学式)
A ;B ;C ;D ;E ;
(2)写出下列反应的离子方程:
①C溶液与E溶液在加热条件下反应 ;
②过量E溶液与D溶液反应 ;
查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题
A.氢氧化钠溶液中通入少量二氧化硫(性质与CO2类似):SO2+OH-===HSO3-
B.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C.盐酸滴入氨水中:H++OH-===H2O
D.碳酸钙 溶解于稀硝酸中:CO32-+2H+===CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com