
【题目】下列关于硫及其化合物说法正确的是
A.硫粉和铜粉共热时反应生成黑色的硫化铜
B.浓硫酸具有吸水性,可以干燥H2S、SO2等气体
C.FeSO4可用于生产防治缺铁性贫血的药剂
D.某溶液中加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液中含有![]()
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】I、如图所示,X是一种生活中常见的金属元素,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间(实验中所有溶液均足量)。

(1)甲池是___(填“原电池”或“电解池”,下同]装置;乙池是___装置。
(2)D极为___(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_______(填“a”或“b”);C极上的电极反应式为____。
(4)F极上的电极反应式为:____。
(5)当电路中通过0.02mol电子时,B电极上沉积0.64g金属X,则X为___(填元素符号),甲池中反应的化学方程式为___。
II、(1)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的数目为____;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是___。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见如图1。其原因是___。

③353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为:___,CuCl+FeCl3=CuCl2+FeCl2。
(2)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见如图2。转化时正极的电极反应式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是科技、生产、生活中应用最广泛的金属材料。

现有铁、铝的混合物进行如下实验:
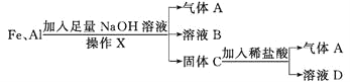
(1)操作X的名称是_____。
(2)气体A是_____。
(3)A与Cl2混合光照可能发生爆炸,生成_____(填化学式),A在该反应中作为_____(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有_____,溶液D中存在的金属离子为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用资源,加强环境保护,降低碳排放,实施低碳经济是今后经济生活主流。回答下列问题:
(1)下列措施不利于有效减少二氧化碳的是_______(填字母)。
a.植树造林,保护森林,保护植被
b.加大对煤和石油的开采,并鼓励使用液化石油气
c.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
d.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1:4的物质的量之比混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:
CO2+4H2![]() _______+2H2O
_______+2H2O
(3)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2 mol CO2和6 mol H2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),能判断该反应已达化学平衡的标志是____(填字母)。
CH3OH(g)+H2O(g),能判断该反应已达化学平衡的标志是____(填字母)。
a.CO2百分含量保持不变
b.容器中混合气体的质量保持不变
c.容器中H2浓度与CO2浓度之比为3:1
d.CO2的生成速率与CH3OH的生成速率相等
现测得CO2相CH3OH (g)的浓度随时间变化如图所示。
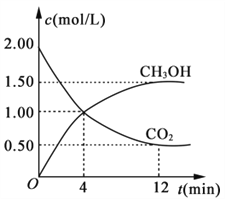
从反应开始到平衡,氢气的平均反应速率v(H2)=________。
(4)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2 CO3+6H2O。通入甲醇的电极为燃料电池的______(填“正”或“负”)极,正极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2 和熔融 KNO3 可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物 Y,Y 可循环使用。下列说法正确的是
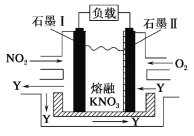
A.放电时,NO![]() 向石墨Ⅱ电极迁移
向石墨Ⅱ电极迁移
B.电池总反应式为 4NO2+O2===2N2O5
C.石墨Ⅱ附近发生的反应为 NO+O2+e- ===NO![]()
D.当外电路通过 4 mol e-,负极上共产生 2 mol N2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH2Cl2的空间构型为______;聚丙烯的链节为______。
(2)比较Li+和H-半径大小r(Li+)____r(H-)(填“>”或“<”),并说明理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲氧基甲烷[CH2(OCH3)2]水溶性好、含氧量高、燃烧完全、烟气排放量低,被认为是一种极具应用前景的柴油添加剂。工业生产CH2(OCH3)2一般是在催化剂作用下,将37%的甲醛(HCHO)水溶液和甲醇(CH3OH)混合共热,反应原理如下:HCHO+2CH3OH![]() CH2(OCH3)2+H2O
CH2(OCH3)2+H2O
(1)某次研究反应时间对产率的影响的实验中,CH2(OCH3)2的浓度随反应时间变化如表:
时间(min) | 20 | 25 | 30 | 40 | 50 | 60 |
CH2(OCH3)2 (mol/L) | 9.02 | 9.10 | 9.18 | 9.23 | 9.30 | 9.32 |
计算25~50min中CH2(OCH3)2的平均生成速率为___。
(2)研究反应的化学平衡常数(记作lnK)与温度(T)的关系如图所示,判断该反应的△H___0(填“>”、“<”、“=”)。
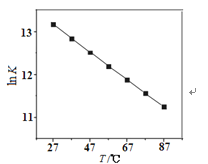
(3)假设在密闭容器中发生上述反应:
①达到平衡时下列措施能提高HCHO转化率的是___。
A.及时从反应体系中分离出CH2(OCH3)2
B.升高反应体系的温度
C.再添加适量甲醇
D.再添加一定量甲醛
②下图是催化剂作用下甲醇转化率随时间变化的趋势曲线图。请在图中用虚线画出相同条件下,不使用催化剂时转化率随时间变化的曲线。___
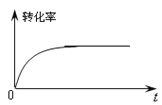
(4)进一步研究发现:甲醛的滴加速率、反应时间、催化剂的量和搅拌速率等对CH2(OCH3)2的工业实际产率(不完全是平衡状态下得出的)也会产生一定影响。欲分别研究甲醛的滴加速率、搅拌速率对产率的影响,某同学设计了三组实验如表:
影响因素 实验号 | 甲醛的滴加速率(g/min) | 反应时间(min) | 催化剂的量(g) | 搅拌速率(r/min) |
1 | ___ | 70 | 2.5 | 30 |
2 | 1.0 | ___ | ___ | ___ |
3 | 2.5 | ___ | ___ | 80 |
①请在上表空格中填入剩余的实验条件数据。
②在研究过程中发现,甲醛(HCHO)的滴加速率过慢或过快均会使CH2(OCH3)2产率降低。请结合该反应的合成机理:HCHO![]() HOCH2OCH3
HOCH2OCH3![]() CH2(OCH3)2,试分析甲醛的滴加速率过快时,导致产率较低的原因可能是___。
CH2(OCH3)2,试分析甲醛的滴加速率过快时,导致产率较低的原因可能是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com