


科目:高中化学 来源: 题型:
| A、氧化性强弱的顺序为:XO4一>Z2>B2>A3+ |
| B、Z2在①、③反应中为还原剂 |
| C、溶液中可发生:Z2+2A2+=2A3++2Z一 |
| D、X2十是XO4一的氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、活性炭、SO2、氯水都会因发生氧化还原反应而使品红溶液褪色 |
| B、Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| C、常温下,浓硫酸、浓硝酸与铝均能发生钝化,均能用铝罐储运 |
| D、水玻璃,从分类法的角度,可看作纯净物,可用于木材等的防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
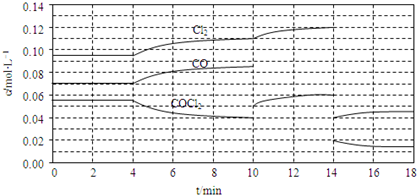
查看答案和解析>>
科目:高中化学 来源: 题型:
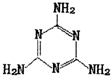 Ⅰ.CN-能与Ni2+形成[Ni(CN)4]2-配离子
Ⅰ.CN-能与Ni2+形成[Ni(CN)4]2-配离子查看答案和解析>>
科目:高中化学 来源: 题型:
 化学能转变成热能、化学能转变成电能是能量转化的重要形式.
化学能转变成热能、化学能转变成电能是能量转化的重要形式.查看答案和解析>>
科目:高中化学 来源: 题型:
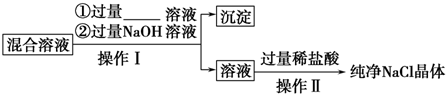
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、馒头、榨菜、黄瓜、香蕉 |
| B、面条、醋溜土豆丝、素炒白菜 |
| C、米饭、糖醋排骨、粉蒸肉、清蒸鲈鱼 |
| D、米饭、红烧鲫鱼、西红柿蛋汤、蒜蓉生菜、苹果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com